Bài 18.4 Trang 22 Sách bài tập (SBT) Hóa học 9
Nhằm xác định vị trí của những kim loại X, Y, Z, T trong dãy hoạt động hoá học, người ta thực hiện phản ứng của kim loại với dung dịch muối của kim loại khác, thu được những kết quả sau :
Thí nghiệm 1 : Kim loại X đẩy kim loại z ra khỏi muối.
Thí nghiệm 2 : Kim loại Y đẩy kim loại z ra khỏi muối.
Thí nghiệm 3 : Kim loại X đẩy kim loại Y ra khỏi muối.
Thí nghiệm 4 : Kim loại z đẩy kim loại T ra khỏi muối.
Em hãy sắp xếp các kim loại theo chiều mức độ hoạt động hoá học giảm dần.
Trả lời
Mức độ hoạt động hoá học của các kim loại theo chiều giảm dần :
X > Y > Z > T
Bài 18.5 Trang 23 Sách bài tập (SBT) Hóa học 9
Viết các phương trình hóa học thực hiện những chuyển đổi hóa học sau:
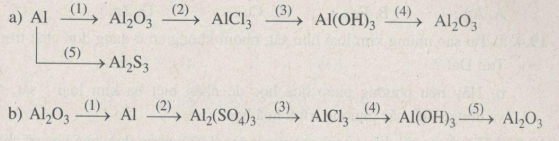
Trả lời
a)
\((1)\,\,4Al + 3{O_2}\buildrel {{t^o}} \over\longrightarrow 2A{l_2}{O_3}\)
\((2)\,\,A{l_2}{O_3} + 6HCl \to 2AlC{l_3} + 3{H_2}O\)
\((3)\,\,\,AlC{l_3} + 3NaOH \to Al{(OH)_3} \downarrow + 3NaCl\)
\((4)\,\,2Al{(OH)_3}\buildrel {{t^o}} \over\longrightarrow A{l_2}{O_3} + 3{H_2}O\)
\((5)\,\,2Al + 3S\buildrel {{t^o}} \over\longrightarrow A{l_2}{S_3}\)
b)
\((1)\,\,2A{l_2}{O_3}\mathrel{\mathop{\kern0pt\longrightarrow}\limits_{criolit}^{đpnc}} 4Al + 3{O_2}\)
\((2)\,\,2Al + 3{H_2}S{O_{4(loang)}} \to A{l_2}{(S{O_4})_3} + 3{H_2} \uparrow \)
\((3)\,\,A{l_2}{(S{O_4})_3} + 3BaC{l_2} \to 3BaS{O_4} \downarrow + 2AlC{l_3}\)
\((4)\,\,AlC{l_3} + 3NaOH \to Al{(OH)_3} \downarrow + 3NaCl\)
\((5)\,\,2Al{(OH)_3}\buildrel {{t^o}} \over\longrightarrow A{l_2}{O_3} + 3{H_2}O\)
Bài 18.6* Trang 23 Sách bài tập (SBT) Hóa học 9
Nhúng một lá nhôm vào dung dịch CuSO4. Sau một thời gian, lấy lá nhôm ra khỏi dung dịch thì thấy khối lượng dung dịch giảm 1,38 gám. Khối lượng của Al đã tham gia phản ứng là
A. 0,27 gam ; B. 0,81 gam ; C. 0,54 gam ; D. 1,08 gam.
Trả lời
Đáp án C.
Cách 1 :
Gọi khối lượng miếng Al là a gam, lượng nhôm đã phản ứng là x gam :
2Al + 3CuSO4 -----------> Al2(S04)3 + 3 Cu
2 x 27 gam 3 x 64 gam
x gam \({{3 \times 64 \times x} \over {27 \times 2}}gam\)
So với khối lượng miếng Al ban đầu thì khối lượng miếng Al sau phản ứng tăng 1,38 gam. Ta có phương trình :
\((a - x) + {{192x} \over {54}} = a + 1,38\) => x= 0,54(gam)
Cách 2: \(2Al + 3CuS{O_4} \to A{l_2}{(S{O_4})_3} + 3Cu\)
2 mol 3 mol
x mol \({{3x} \over 2}\)
\({{3x} \over 2} \times 64 - 27x = 1,38 \to x = 0,02(mol);{m_{Al}} = 0,54(gam)\)
Giaibaitap.me
Giải bài tập trang 23 bài 18 nhôm Sách bài tập (SBT) Hóa học 9. Câu 18.7: Hoà tan 4,5 gam hợp kim nhôm - magie trong dung dịch H2S04 loãng, dư, thấy có 5,04 lít khí hiđro bay ra (đktc)....
Giải bài tập trang 23, 24 bài 19 sắt Sách bài tập (SBT) Hóa học 9. Câu 19.1: Muối Fe (III) được tạo thành khi cho Fe tác dụng với dung dịch...
Giải bài tập trang 24 bài 19 sắt Sách bài tập (SBT) Hóa học 9. Câu 19.5: Ở Việt Nam có những loại quặng sắt nào ? Viết công thức hoá học và cho biết địa điểm của những loại quặng đó....
Giải bài tập trang 24 bài 19 sắt Sách bài tập (SBT) Hóa học 9. Câu 19.9: Cho 7,2 gam một oxit sắt tác dụng với dung dịch axit HCl có dư...
