Bài 36.5 Trang 46 Sách bài tập (SBT) hóa học 9
36.5. Propan là hiđrocacbon có tính chất tương tự metan và có công thức phân tử C3H8
a) Viết công thức cấu tạo của propan.
b) Viết phương trình hoá học của phản ứng đốt cháy propan.
c) Viết phương trình hoá học của phản ứng giữa propan và clo khi chiếu sá để tạo ra C3H7Cl.
Trả lời
a) Công thức cấu tạo của C3H8
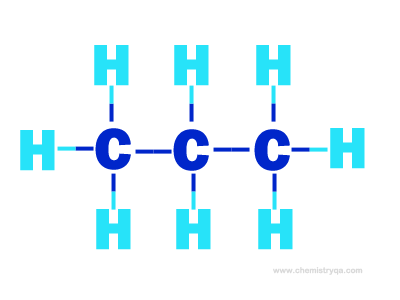
b) \({C_3}{H_8} + 5{O_2} \to 3C{O_2} + 4{H_2}O\)
c) \({C_3}{H_8} + C{l_2}\buildrel {as} \over\longrightarrow {C_3}{H_7}Cl + HCl\)
Bài 36.6 Trang 46 Sách bài tập (SBT) Hóa học 9
Khi cho metan tác dụng với clo có chiếu sáng theo tỉ lệ 1 : 1 về số mol, người thấy ngoài sản phẩm chính là CH3Cl còn tạo ra một hợp chất X trong phần trăm khối lượng của clo là 83,53%. Hãy xác định công thức phân tử của X.
Trả lời
Sản phẩm tạo ra có công thức: \(C{H_{4 - a}}C{l_a}\)
\( \Rightarrow {{35,5a} \over {12 + 4 - a + 35,5a}} \times 100 = 83,53\)
=> a =2. Vậy công thức của X là \(C{H_2}C{l_2}\)
Bài 36.7 Trang 46 Sách bài tập (SBT) Hóa học 9
36.7. Hỗn hợp X gồm CH4 và hiđrocacbon A. Đốt cháy hoàn toàn 4,48 lít hỗn h X rồi cho toàn bộ sản phẩm thu được hấp thụ hết vào dung dịch Ca(OH)2 dư thấy tạo ra 50 gam kết tủa và khối lượng bình đựng dung dịch Ca(OH)2 tăng thêm 34,6 gam.
Xác định công thức phân tử của A, biết trong hỗn hợp số mol của A gấp lần số mol của CH4.
Trả lời
\({n_X} = {{4,48} \over {22,4}} = 0,2(mol) \Rightarrow {n_{C{H_4}}} = {{0,2} \over 4} = 0,05(mol);{n_A} = 0,05 \times 3 = 0,15(mol)\)
Phương trình hóa học: \(C{H_4} + 2{O_2} \to C{O_2} + 2{H_2}O\)
\({C_n}{H_m} + (n + {m \over 4}){O_2} \to {n_{C{O_2}}} + {m \over 2}{H_2}O\)
\(C{O_2} + Ca{(OH)_2} \to CaC{O_3} \downarrow + {H_2}O\)
\({n_{C{O_2}}} = {n_{CaC{O_3}}} = {{50} \over {100}} = 0,5(mol) \Rightarrow {m_{C{O_2}}} = 0,5 \times 44 = 22(gam)\)
\({m_{{H_2}O}} = 34,6 - 22 = 12,6(gam)\)
\( \Rightarrow {m_{{H_2}O}} = {{12,6} \over {18}} = 0,7(mol) \Rightarrow {n_{C{O_2}}},{n_{{H_2}O}}\) tạo ra khi đốt cháy A là
\({n_{C{O_2}}} = 0,5 - 0,05 = 0,45(mol);{n_{{H_2}O}} = 0,7 - 0,1 = 0,6(mol)\)
=> Công thức của A là \({C_3}{H_8}\)
Giaibaitap.me
Giải bài tập trang 46, 47 bài 37 etilen Sách bài tập (SBT) Hóa học 9. Câu 37.1: Etilen là chất...
Giải bài tập trang 47 bài 37 etilen Sách bài tập Hóa học 9. Câu 37.5: Chất hữu cơ X khi đốt cháy tuân theo phương trình hoá học...
Giải bài tập trang 47, 48 bài 38 Axetilen Sách bài tập (SBT) Hóa học 9. Câu 38.1: Có các dãy chất sau...
Giải bài tập trang 48 bài 38 Axetilen Sách bài tập (SBT) Hóa học 9. Câu 38.5: Tính khối lượng khí C2H2 thu được khi cho 128 gam CaC2 tác dụng hết với H20....
