Bài 6.20 trang 61 Sách bài tập (SBT) Hóa học 10
Có một hỗn hợp chất rắn gồm bột lưu huỳnh và. bột sắt. Nêu phương pháp hoá học tách riêng bột lưu huỳnh ra khỏi hỗn hợp. Viết PTHH.
Lời giải:
Có nhiều phương pháp tách s ra khỏi hỗn hợp bột s và bột Fe. Sau đây là một thí dụ :
Khuấy hỗn hợp bột s và Fe trong dung dịch HCL hoặc dung dịch \(H_2SO_4\) loãng, dư cho đến khi không còn bọt khí thoát ra. Lọc hỗn hợp sau phản ứng và rửa sạch, được bột lưu huỳnh.
PTHH của phản ứng xảy ra:
\(Fe +2HCl → FeCl_2 +H_2\)
\( Fe +2H_2SO_4 → FeSO_4 +H_2\)
Bài 6.21 trang 61 Sách bài tập (SBT) Hóa học 10
Đốt nóng một hỗn hợp gồm 6,4 gam bột lưu huỳnh và 15 gam bột kẽm trong môi trường kín không có không khí.
a)Viết PTHH của các phản ứng.
b)Cho biết vai trò các chất tham gia phản ứng.
c) Chất nào còn lại sau phản ứng ? Khối lượng là bao nhiêu ?
Lời giải:
a) Zn + S → ZnS
b) Zn : Chất khử hay chất bị oxi hoá.
S : Chất oxi hoá hay chất bị khử.
c) \({n_{Zn}} = {n_S} = {{6,4} \over {32}} = 0,2 \Rightarrow {m_{Zn}} = 0,2 \times 65 = 13\left( g \right)\)
Zn dư, khối lượng là 2 gam
Bài 6.22 trang 62 Sách bài tập (SBT) Hóa học 10
Đốt nóng một hỗn hợp gồm 5,6 gam bột sắt và 1,6 gam bột lưu huỳnh trong môi trường không có không khí, thu được hỗn hợp rắn X. Cho hỗn hợp X phản ứng hoàn toàn với 500 ml dung dịch HCL, thu được hỗn hợp khí A và dung dịch B (hiệu suất của các phản ứng là 100%).
a) Tính thành phần phần trăm theo thể tích của hỗn hợp khí A
b) Biết rằng cần dùng 125 ml dung dịch NaOH 0,1M để trung hoà HCL còn dư trong dung dịch B, hãy tính nồng độ mol của dung dịch HCL đã dùng.
Lời giải:
Các PTHH:
Fe+ S → FeS (1)
\(FeS + 2HCL → FeCl_2 + H_2S\) (2)
\(Fe (dư) + 2HCL → FeCl_2 + H_2\) (3)
\(HCL (dư) + NaOH → NaCl + H_2\) (4)
a) Thành phần của hỗn hợp khí A :
Theo (1) : 0,05 mol Fe tác dụng với 0,05 mol S, sinh ra 0,05 mol FeS.
Theo (2) : 0,05 mol FeS tác dụng với 0,10 mol HCL, sinh ra 0,05 mol \(H_2S\).
Theo (3) : 0,05 moi Fe dư tác dụng với 0,10 mol HCL, sinh ra 0,05 mol HCl
Kết luận : Hỗn hợp khí A có thành phần phần trăm theo thể tích :
50% khí \(H_2S\) và 50% khí \(H_2\).
b) Nồng độ mol của dung dịch HCL :
Tổng số mol HCL tham gia các phản ứng (2), (3), (4) :
0,1 + 0,1 + 0,0125 = 0,2125 (mol)
Nồng độ mol của dung dịch HCL : \({{0,2125} \over {0,5}} = {\rm{ }}0,425\left( {mol/1} \right)\).
Bài 6.23 trang 62 Sách bài tập (SBT) Hóa học 10
Viết phương trình hoá học của các phản ứng hoàn thành chuỗi phản ứng sau :
![]()
Lời giải:
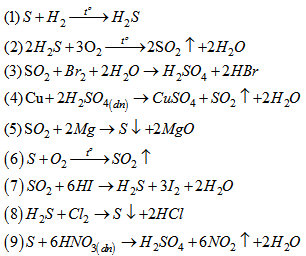
Bài 6.24 trang 62 Sách bài tập (SBT) Hóa học 10
Cho sơ đồ chuỗi phản ứng :
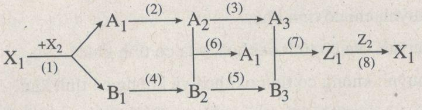
Biết rằng : \(X_1\) là hợp chất của 1 kim loại và 1 phi kim.
\(A_1, A_2, A_3, Z_1\) là các hợp chất của lưu huỳnh
\(B_1, B_3, B_5, Z_1\) là hợp chất của đồng hoặc đồng kim loại.
Hãy viết PTHH của chuỗi phản ứng (có ghi điều kiện) xảy ra theo sơ đồ trên.
Lời giải:
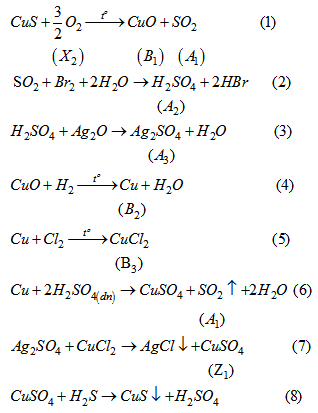
Bài 6.25 trang 62 Sách bài tập (SBT) Hóa học 10
Cho 1,10 gam hỗn hợp bột sắt và bột nhôm tác dụng vừa đủ với 1,28 gam bột lưu huỳnh.
a)Viết PTHH của các phản ứng đã xảy ra.
b)Tính tỉ lệ % của sắt và nhôm trong hỗn hợp ban đầu theo :
+ Lượng chất (số mol).
+ Khối lượng chất (số gam).
Lời giải:

Bài 6.26 trang 62 Sách bài tập (SBT) Hóa học 10
Đun nóng một hỗn hợp gồm có 0,650 gam bột kẽm và 0,224 gam bột lưu huỳnh trong ống nghiệm đậy kín không có không khí.Sau phản ứng người ta thu được chất nào trong ống nghiệm ? Khối lượng là bao nhiêu ?
Lời giải:
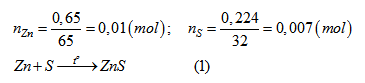
Theo (1) sau phản ứng trong ống nghiệm thu được:
\({n_{ZnS}} = 0,007\,mol;\,\,\,\,{m_{ZnS}} = 97.0,007 = 0,679\left( g \right)\)
\(n_{Zn (dư)}\)= (0,01- 0,007) =0,003 (mol); \(m_{Zn dư}\)=65 . 0,003 = 0,195 (g)
Bài 6.27 trang 62 Sách bài tập (SBT) Hóa học 10
Đốt cháy lưu huỳnh trong bình đựng không khí, lưu huỳnh cháy hết. Tính tỉ khối đối với He của hỗn hợp khí thu được sau phản ứng, nếu oxi trong bình vừa đủ đốt cháy hết S.
Lời giải:
Nitơ chiếm 80% thể tích không khí, điều đó có nghĩa là trong không khí mỗi khi có 1 mol oxi sẽ có 4 mol nitơ.
\( S + O_2 → SO_2\)
Khi tạo thành 1 mol \(SO_2\) thì hỗn hợp thu được gồm 1 mol \(SO_4\) và 4 mol \(N_2\)
\(\overline M = {{64 + 28 \times 4} \over 5} = 35,2\left( {g/mol} \right)\)
Tỉ khối của hỗn hợp đối với He là : \(d = {{35,2} \over 4} = 8,8\)
Giaibaitap.me
Giải bài tập trắc nghiệm trang 63 bài 32 Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit Sách bài tập (SBT) Hóa học 10. Câu 6.28: Câu nào sau đây diễn tả đúng tính chất của chất ...
Giải bài tập trang 61 bài 30 lưu huỳnh Sách bài tập (SBT) Hóa học 10. Câu 6.30: Hệ số của chất oxi hoá và hệ số của chất khử trong PTHH của phản ứng trên là...
Giải bài tập trang 65, 66 bài 30 lưu huỳnh Sách bài tập (SBT) Hóa học 10. Câu 6.36: Đốt cháy hoàn toàn 3,4 gam hợp chất A...
Giải bài tập trang 66, 67 bài 32 Hiđro sunfua - Lưu huỳnh đioxit - Lưu huỳnh trioxit Sách bài tập (SBT) Hóa học 10. Câu 6.41: Viết PTHH của các phản ứng của...
