Bài 6.72 trang 72 Sách bài tập (SBT) Hóa học 10
So sánh thể tích khí oxi được sinh ra (đo cùng điều kiện nhiệt độ và áp suất) khi nhiệt phân hoàn toàn mỗi chất sau : \(KMnO_4, KClO_3\) (xúc tác là \(MnO_2\)), \(KNO_3\) trong các trường hợp sau :
a)Các chất được lấy cùng khối lượng.
b) Các chất được lấy cùng số mol.
Lời giải:
Các PTHH :
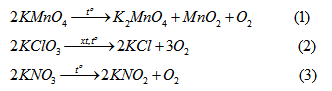
a) Các chất được lấy cùng khối lượng :
Khối lượng mỗi chất là m gam, từ các PTHH (1), (2), (3) ta tính được số mol \(O_2\) sinh ra lần lươt là : \({m \over {316}}mol, {m \over {81,7}} mol và {m \over {2O_2}}mol.\)
Kết luận : Khí oxi sinh ra ở (2) có thể tích lớn nhất, khí oxi sinh ra ở (1) có thể tích nhỏ nhất.
b) Các chất được lấy cùng số mol:
Số mol mỗi chất là n mol, từ các PTHH (1), (2), (3) ta tính được số mol \(O_2\) sinh ra lần lượt là : 0,5n, 1,5n và 0,5n.
Kết luận : Khí oxi sinh ra ở (2) có thể tích lớn nhất, khí oxi sinh ra ở (1) và (3) là bằng nhau.
Bài 6.73 trang 72 Sách bài tập (SBT) Hóa học 10
Có 4 dung dịch không màu được đựng riêng biệt là : \(NaCl, Na_2SO_4, Na_2CO_3, HCL\). Hãy phân biệt mỗi dung dịch trên bằng phương pháp hoá học với điều kiện dùng thuốc thử là dung dịch \(BaCl_2\)
Lời giải:
Có thể dựa vào sơ đồ phân tích sau để nhận biết.
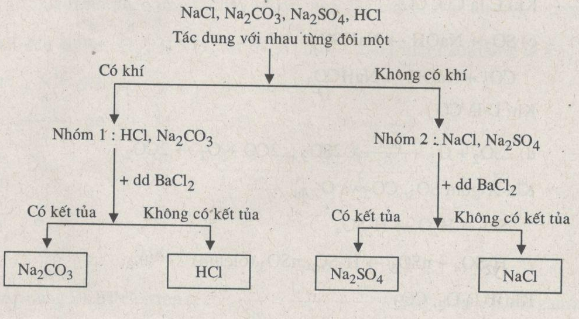
Phương trình phản ứng:
(1) 2HCl + Na2CO3 → 2NaCl + H2O + CO2↑
(2) BaCl2 + Na2CO3 → BaCO3↓ + 2NaCl
(3) Na2SO4 + BaCl2 → BaSO4↓ + 2NaCl
Bài 6.74 trang 72 Sách bài tập (SBT) Hóa học 10
Cho 35,6 gam hỗn hợp hai muối \(Na_2SO_3, NaHSO_3 \) tác dụng với một lượng dư dung dịch \(H_2SO_4\). Khi phản ứng kết thúc, người ta thu được 6,72 lít khí (đktc).
a) Viết PTHH của những phản ứng đã xảy ra.
b) Tính khối lượng mỗi muối trong hỗn hợp ban đầu.
Lời giải:
a) Các PTHH :
\(Na_2SO_3 + H_2SO_4 → Na_2SO_4 + H_2O + SO_2↑\) (1)
\(2NaHSO_3 + H_2SO_4 → Na_2SO_4 + 2H_2O + 2SO_2↑\) (2)
b) Khối lượng mỗi muối trong hỗn hợp :
Đặt x và y là số mol của muối \(Na_2SO_3\) và \(NaHSO_3\) trong hổn hợp. Từ đó ta có hệ phương trình đại số :
\(\left\{ \begin{array}{l}
126x + 104y = 35,6\\
x + y = 0,3
\end{array} \right.\)
Giải hệ phương trình, ta được : x = 0,2 và y = 0,1.
Đáp số: \(m_{Na_2SO_4}=25,2 gam\)
\(m_{NaHSO_3} = 10,4 gam\)
Bài 6.75 trang 72 Sách bài tập (SBT) Hóa học 10
Hoàn thành chuỗi phản ứng sau :
Hỗn hợp khí A gồm \(CO, CO_2, SO_2\)
a)\(A + dd NaOH_{dư} → khí B_1+ dd B_2\)
b) \(A + dd H_2S\) → khí C
c) A + NaOH → khí D
(NaOH trong dd nước, để trong không khí)
d) A +\(O_2\) dư ![]() khí X
khí X
\(X + dd H_2SO_4\) 90% → khí Y + chất lỏng Z
Lời giải:
a) \(SO_2 + 2NaOH → Na_2SO_3 + H_2O\)
\(CO_2 + 2NaOH → Na_2CO_3 + H_2O\)
Khí \(B_1\) là CO; dd\(B_2\) chứa \(Na_2CO_3, Na_2SO_3\)
b) \(SO_2 + 2H_2S → 3S↓ + 2H_2O\)
Khí C là CO, \(CO_2\)
c) \(SO_2 + NaOH → NaHSO_3 \)
\(CO_2 + NaOH → NaHCO_3\)
Khí D là CO
d) \(2SO_2 + O_2 ![]() 2SO_3 ; 2CO + O_2 → 2CO_2\)
2SO_3 ; 2CO + O_2 → 2CO_2\)
Khí X gồm \(SO_3, CO_2 \,và\, O_2\) dư
\(SO_3 + H_2O → H_2SO_4\)
\(H_2SO_4 + nSO_3 → H_2SO_4.nSO_3\) (oleum)
Khí Y là \(O_2, CO_2\)
Chất lỏng Z là oleum.
Bài 6.76 trang 73 Sách bài tập (SBT) Hóa học 10
Để đốt cháy hoàn toàn 0,672 gam kim loại R chỉ cần dùng 80% lượng oxi sinh ra khi phân huỷ 5,53 gam \(KMnO_4\). Hãy xác định kim loại R.
Lời giải:
\(n_{KMnO_4}\) =\(\frac{{5,53}}{{158}} = 0,035\left( {mol} \right)\)
![]()
Số mol oxi tham gia phản ứng là \(0,0175.{{80} \over {100}} = 0,014\left( {mol} \right)\)
Đặt n là hóa trị của R (n = 1,2,3)
\(\begin{array}{l}
4R\,\,\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,\,\,\,n{O_2} \to 2{{\rm{R}}_2}{O_n}\\
\frac{{0,0144}}{n}mol\,\,\,\,\,\,\,\,\,\,0,014\,mol
\end{array}\)
Ta có: \({{0,014.4} \over n}.R - 0,672\left( g \right) \to R = 12n\)
Từ (1):
n 1 2 3
R 12 24 36
Không có KL nào Mg Không có KL nào
Kim loại có hóa trị II có A =24 → Mg
Bài 6.77 trang 73 Sách bài tập (SBT) Hóa học 10
Nung m gam bột Fe trong O_2 thu được 11,36 gam hỗn hợp X gồm \(Fe, FeO, Fe_2O_3 \,và\, Fe_3O_4\). Cho toàn bộ X phản ứng hết với dung dịch \(HNO_3\) loãng dư, thu được 1,344 lít khí NO (sản phẩm khử duy nhất,ở đktc).
Tìm m.
Lời giải:
- Từ quá trình phản ứng ta thấy số oxi hoá của các chất phản ứng ở trạng thái đầu là \(\mathop {Fe}\limits^0 ,\mathop {{O_2}}\limits^0 ,H\mathop N\limits^{ + 5} {O_3}\) và số oxi hoá ở trạng thái cuối cùng là \(F{e^{ + 3}},{O^{2 - }},{N^{ + 2}}\). Khi đó :
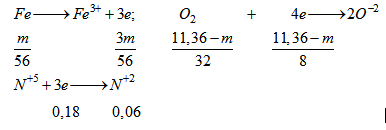
Áp dụng ĐLBT electron ta có: \({{3m} \over {56}} = {{11,36 - m} \over 8} + 0,18 \Rightarrow m = 8,96\left( {gam} \right)\)
Bài 6.78 trang 73 Sách bài tập (SBT) Hóa học 10
Nung m gam hỗn hợp bột Fe và S trong bình kín không có không khí. Sau phản ứng đem phần rắn thu được hòa tan vào lượng dư dung dịch HCl được 3,8 gam chất rắn X không tan, dung dịch Y và 0,2 mol khí z. Dẫn z qua dung dịch Cu(NO_3)2 dư, thu được 9,6 gam kết tủa đen.
Tìm m.
Lời giải:
- Chất rắn không tan trong HCL dư là S => \(m_S\) dư =3,8 gam
Kết tủa đen là \(CuS => n_{CuS} = 0,1 = n_{H_2S} = n_{S phản ứng}\)
→ \(m_{ S\,\,phản\,ứng} =3,2 gam\)
0,2 mol Z gồm 0,1 mol \(H_2S\) và 0,1 mol \(H_2\)
→ \(m_{ban\,đầu}=3,8+3,2=7 gam\)
Ta lại có
\(n_{Fe\,phản\, ứng} = n_{S\,phản \,ứng} =0,1\)
\(n_{Fe\,dư} = n_{H_2} = 0,1\)
\(n_Fe\,ban\,đầu\) → \(m_Fe\,ban\,đầu\) =0,2.56 =1 1,2(gam)
Vậy m = 11,2 + 0,7 = 18,2 (gam)
Giaibaitap.me
Giải bài tập trắc nghiệm trang 74 bài 36 Tốc độ phản ứng hóa học Sách bài tập (SBT) Hóa học 10. Câu 7.1: Trong phòng thí nghiệm, có thể điều chế khí oxi từ muối kali clorat...
Giải bài tập trang 75, 76 bài 36 Tốc độ phản ứng hóa học Sách bài tập (SBT) Hóa học 10. Câu 7.1: Các yếu tố như nhiệt độ, áp suất chất khí...
Giải bài tập trang 77, 78 bài 38 Cân bằng hóa học Sách bài tập (SBT) Hóa học 10. Câu 7.11: Hãy cho biết những cặp yếu tố nào sau đây ảnh hưởng đến sự chuyển dịch cân bằng hoá học trên...
Giải bài tập trang 78, 79, 80 bài 38 Cân bằng hóa học Sách bài tập (SBT) Hóa học 10. Câu 7.18: Phản ứng hoá học sau đã đạt trạng thái cân bằng...
