Bài 7.31 trang 82 Sách bài tập (SBT) Hóa học 10
Cho các phản ứng hoá học :
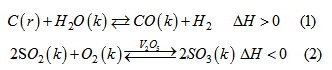
a) Hãy so sánh các đặc điểm của hai phản ứng hoá học trên.
b) Nêu các biện pháp kĩ thuật để làm tăng hiệu suất sản xuất.
Lời giải:
a) So sánh các đặc điểm của hai phản ứng hoá học :
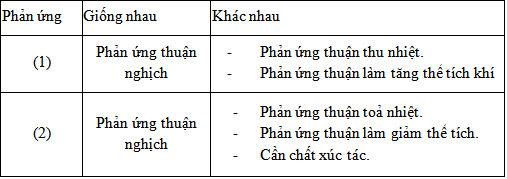
b) Các biện pháp kĩ thuật để làm tăng hiệu 'suất sản xuất:
- Đối với phản ứng (1) : Tăng nhiệt độ, tăng nồng độ của hơi nước.
- Đối với phản ứng (2) : Nếu giảm nhiệt độ, cân bằng chuyển sang chiều thuận, tuy nhiên ở nhiệt độ thấp tốc độ của phản ứng thấp làm cho quá trình sản xuất không kinh tếẳ Người ta chọn nhiệt độ thích hợp, dùng chất xúc tác \(V_2O_5\) và tăng áp suất chung của hệ phản ứng.
Bài 7.32 trang 82 Sách bài tập (SBT) Hóa học 10
Đồ thị nào sau đây biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian ? Sự biến đổi tốc độ phản ứng nghịch theo thời gian ? Trạng thái cân bằng hoá học ?
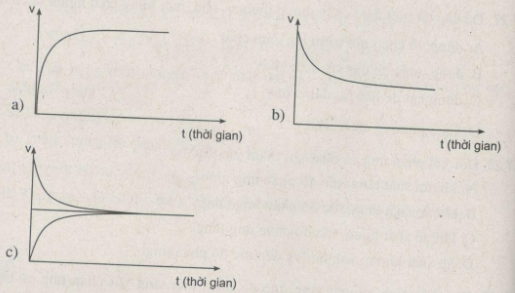
Lời giải:
Đồ thị a biểu diễn sự biến đổi tốc độ phản ứng thuận theo thời gian.
Đồ thị b biểu diễn sự biến đổi tốc độ phản ứng nghịch theo thời gian.
Đồ thị c biểu diễn trạng thái cân bằng hoá học.
Bài 7.33 trang 82 Sách bài tập (SBT) Hóa học 10
Vì sao không nển để than đá hay giẻ lau máy đã qua sử dụng thành một đống lớn ?
Lời giải:
Phản ứng oxi hoá than đá (dầu, mỡ lau máy) ở nhiệt độ thường mặc dù diễn ra rất chậm, nhưng là phản ứng hoá học toả nhiệt. Nhiệt toả ra tích tụ lại làm tăng nhiệt độ của đống than (giẻ lau máy) đến điểm cháy, gây hoả hoạn rất nguy hiểm.
Bài 7.34 trang 82 Sách bài tập (SBT) Hóa học 10
Trong vòng 100 năm qua, nhiệt độ trung bình của Trái Đất đã tăng thêm 0,6 °C. Nguyên nhân chính của hiện tượng này là do sự tăng nồng độ khí cacbon đioxit (\(CO_2\)) trong khí quyển, gây ra hiệu ứng nhà kính. Tương tự hiệu ứng giữ ấm cho thực vật trong các nhà kính trồng rau mùa đông ở vùng ôn đới.
Mặc dù lượng khí \(CO_2\) do công nghiệp thải ra hàng năm rất lớn, tăng nhanh, nhưng tại sao nồng độ của chất khí này trong khí quyển tăng chậm ?
Lời giải:
Hai lí do chính :
Trong lòng biển và đại dương tồn tại cân bằng hoá học :
![]()
Theo nguyên lí chuyển dịch cân bằng, khi nồng độ cacbon đioxit tăng thì cân bằng hoá học chuyển theo chiều thuận, do đó làm giảm nồng độ của cacbon đioxit.
- Sự quang hợp của cây xanh trên lục địa và của tảo ở biển và các đại dương :
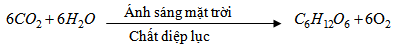
Dù cho có những quá trình tự điều tiết, khống chế sự tăng cacbon đioxit, nhưng con người đang thải lượng cacbon đioxit ngày càng nhiều hơn, vượt quá khả năng tự điều chỉnh của thiên nhiên.
Bài 7.35 trang 83 Sách bài tập (SBT) Hóa học 10
Trong nước ngầm thường có ion \(Fe^{2+}\) dưới dạng muối sắt (II) hiđrocacbonat và sắt (II) hiđroxit. Nước sinh hoạt có chứa ion \(Fe^{2+}\) ảnh hưởng xấu đến sức khoẻ của con người. Để loại bỏ ion \(Fe^{2+}\) một cách đơn giản, rẻ tiền, người ta dùng oxi không khí oxi hoá ion \(Fe^{2+}\), thành hợp chất chứa ion \(Fe^{3+}\) (ít tan trong nước) rồi lọc để thu nước sạch. Để tăng tốc độ của phản ứng oxi hoá ion \(Fe^{2+}\) người ta sử dụng biện pháp kĩ thuật nào ? Giải thích.
Lời giải:
Để tăng tốc độ của phản ứng oxi hoá \(Fe^{2+}\), người ta sử dụng giàn mưa. Nước ngầm sau khi hút lên bể chứa được đưa qua giàn mưa với mục đích tăng diện tích tiếp xúc của nước với oxi không khí.
Giaibaitap.me
Giải bài tập trang 83 bài 39 Luyện tập: Tốc độ phản ứng và cân bằng hóa học Sách bài tập (SBT) Hóa học 10. Câu 7.36: Hãy giải thích và liên hệ với viộc bảo quản thực phẩm bằng cách ướp đá...
