Bài 1 trang 44 SGK Hóa học 10 Nâng cao
Sự biến thiên tính chất của các nguyên tố thuộc chu kì sau lại được lặp lại giống như chu kì trước là do:
A. Sự lặp lại tính kim loại của các nguyên tố ở chu kì sau so với chu kì trước.
B. Sự lặp lại tính phi kim của các nguyên tố ở chu kì sau so với chu kì trước.
C. Sự lặp lại cấu hình electron lớp ngoài cùng của các nguyên tố ở chu kì sau so với chu kì trước.
D. Sự lặp lại tính chất hóa học của các nguyên tố ở chu kì sau so với chu kì trước.
Hãy chọn đáp án đúng.
Giải
Chọn C.
Bài 2 trang 44 SGK Hóa học 10 Nâng cao
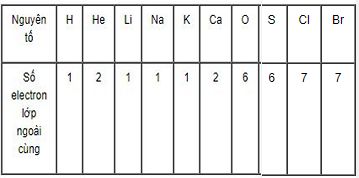
Dựa vào bảng 2.1, hãy cho biết số electron lớp ngoài cùng của nguyên tử các nguyên tố sau đây: H, He, Li, Na, K, Ca, O, S, Cl, Br.
Giải
Bài 3 trang 44 SGK Hóa học 10 Nâng cao
Cho nguyên tử các nguyên tố có Z = 8, Z = 9, Z = 17, Z = 19. Hãy xác định số electron lớp ngoài cùng của nguyên tử các nguyên tố đó, số thứ tự nhóm và chu kì chứa các nguyên tố đó.
Giải
|
Điện tích hạt nhân |
Cấu hình electron |
Số thứ tự nhóm | Chu kì |
|
Z = 8 |
\(1{s^2}2{s^2}2{p^4}\) |
VIA | 2 |
|
Z = 9 |
\(1{s^2}2{s^2}2{p^5}\) |
VIIA | 2 |
|
Z = 17 |
\(1{s^2}2{s^2}2{p^6}3{s^2}3{p^5}\) |
VIIA | 3 |
|
Z = 19 |
\(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}4{s^1}\) |
IA | 4 |
Bài 4 trang 44 SGK Hóa học 10 Nâng cao
Viết cấu hình electron nguyên tử của các nguyên tố có Z = 18 và Z = 19. Tại sao nguyên tố có Z = 18 ở chu kì 3, còn nguyên tố Z = 19 lại ở chu kì 4?
Giải
Cấu hình elctron nguyên tử của nguyên tố có (Z = 18): \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}\)
Nguyên tố này thuộc chu kì 3 vì có 3 lớp electron.
Cấu hình elctron nguyên tử của nguyên tố có (Z = 19): \(1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}4{s^1}\)
Nguyên tố này thuộc chu kì 4 vì có 4 lớp electron.
Bài 5 trang 44 SGK Hóa học 10 Nâng cao
Viết cấu hình electron nguyên tử của các nguyên tố có Z = 20; 21; 24; 29; 30. Cấu hình electron của chúng có đặc điểm gì? Tại sao Cu ở nhóm IB, Zn ở nhóm IIB?
Giải
Cấu hình electron nguyên tử của các nguyên tố:
\(\eqalign{
& Z = 20:\,\,\,1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}4{s^2} \cr
& Z = 21:\,\,\,1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^1}4{s^2} \cr
& Z = 24:\,\,\,1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^5}4{s^1} \cr
& Z = 29:\,\,\,1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^1} \cr
& Z = 30:\,\,\,1{s^2}2{s^2}2{p^6}3{s^2}3{p^6}3{d^{10}}4{s^2} \cr} \)
Nguyên tử của nguyên tố Z = 20 có elctron cuối cùng điền vào phân lớp s của lớp ngoài cùng. Đó là nguyên tố s.
Các nguyên tử của nguyên tố còn lại có electron cuối cùng điền vào phân lớp d sát lớp ngoài cùng. Đó là những nguyên tố d. Ở nguyên tử của nguyên tố Z = 24 và Z = 29 có sự chuyển 1 electron từ phân lớp 4s của lớp ngoài cùng để nhanh chóng làm đầy một nửa hoặc làm bão hòa phân lớp 3d. Những nguyên tố d có phân lớp d đã bão hòa thì số thứ tự nhóm của chúng bằng số electron lớp ngoài cùng. Vì vậy nguyên tử của nguyên tố Cu (Z = 29) có phân lớp 3d đủ 10 electron và lớp ngoài cùng có 1 electron nên ở nhóm IB, còn nguyên tử của nguyên tố Zn (Z = 30) có phân lớp 3d đủ 10 electron và lớp ngoài cùng có 2 electron nên ở nhóm IIB.
Bài 6 trang 44 SGK Hóa học 10 Nâng cao
Sự phân bố electron vào các AO của các nguyên tố C, Ca, Fe và Br sau đây đúng hay sai? Nếu sai hãy sửa lại cho đúng?
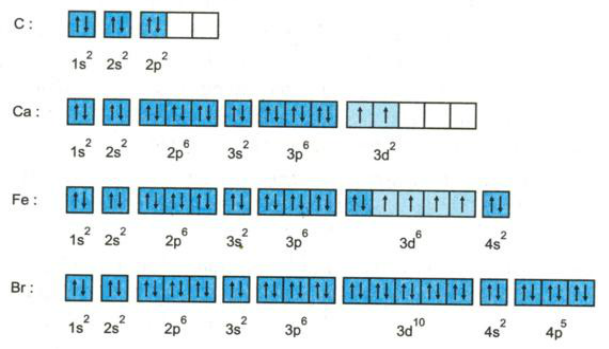
Giải
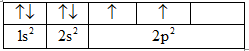
Cấu hình electron nguyên tử của nguyên tố C viết sai. Theo quy tắc Hun, 2 electron ở mức 2p phải phân bố trên 2 obitan 2p. Electron được phân bố như sau:
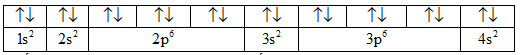
Mức năng lượng 3d cao hơn 4s nên ở nguyên tố Ca, việc viết cấu hình electron đã vi phạm nguyên lí vững bền. Electron được phân bố như sau:
Cấu hình electron nguyên tử của Fe viết đúng.
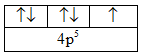
Cấu hình electron nguyên tử của Br viết thừa một electron ở phân lớp 4p. Sửa lại như sau:
Giaibaitap.me
Giải bài tập trang 70 bài 16 Khái niệm về liên kết hóa học. Liên kết ion Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Các nguyên tử liên kết với nhau thành phân tử để...
Giải bài tập trang 75 bài 17 Liên kết cộng hóa trị Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Chọn định nghĩa đúng nhất về liên kết cộng hóa trị...
Giải bài tập trang 80 bài 18 Sự lai hóa các obitan nguyên tử. Sự hình thành liên kết đơn, liên kết đôi và liên kết ba Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Thế nào là sự lai hóa...
Giải bài tập trang 82 bài 19 Luyện tập về: Liên kết ion. Liên kết cộng hóa trị. Sự lai hóa các obitan nguyên tử Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Trình bày nội dung các quy tắc bát tử. ...
