Bài 1 trang 80 SGK Hóa học 10 Nâng cao
Thế nào là sự lai hóa?
Giải
Sự lai hóa obitan nguyên tử là sự tổ hợp “trộn lẫn” một số obitan trong một nguyên tử để được từng ấy obitan lai hóa giống nhau nhưng định hướng khác nhau trong không gian.
Bài 2 trang 80 SGK Hóa học 10 Nâng cao
Lấy các thí dụ minh họa ba kiểu lai hóa đã học.
Giải
Lai hóa sp (phân tử \(Be{H_2}\)), \(s{p^2}\) (phân tử \(B{F_3}\)), \(s{p^3}\) (phân tử \(C{H_4}\)).
Bài 3 trang 80 SGK Hóa học 10 Nâng cao
Mô tả liên kết hóa học trong phân tử \(Be{H_2}\), phân tử \(B{F_3}\), phân tử \(C{H_4}\) theo lý thuyết lai hóa.
Giải
- Phân tử \(Be{H_2}\): Một obitan s và một obitan p của nguyên tử beri tham gia lai hóa để tạo thành 2 obitan lai hóa sp hướng về hai phía đối xứng nhau. Hai obitan này sẽ xen phủ với 2 obitan 1s chứa 1 electron của hai nguyên tử hiđro tạo thành 2 liên kết \(\sigma \) giữa Be – H.
Sơ đồ:

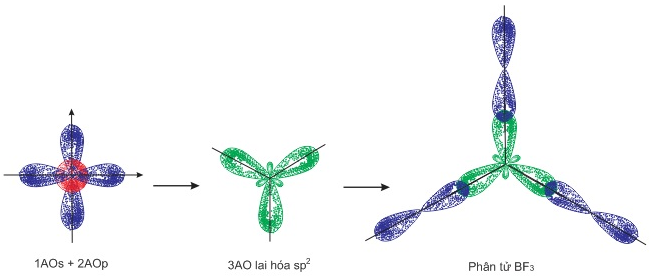
- Phân tử \(B{F_3}\): Trong nguyên tử B một obitan s tham gia lai hóa với 2 obitan p tạo thành 3 obitan lai hóa \(s{p^2}\) định hướng từ tâm đến 3 đỉnh của tam giác đều. 3 obitan này xen phủ với 3 obitan p của flo để tạo thành 3 liên kết \(\sigma \) giữa B – F.
Sơ đồ:
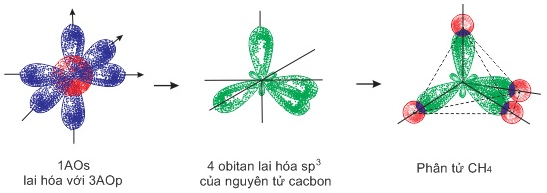
- Phân tử \(C{H_4}\): 1Aos và 3Aop của nguyên tử cacbon đã tiến hành lai hóa để tạo thành 4 obitan lai hóa \(s{p^3}\) định hướng từ tâm đến 4 đỉnh của hình tứ diện đều, các trục đối xứng của chusnfsgtajo thành một góc 109028’. 4 obiatn lai hóa \(s{p^3}\) sẽ xen phủ với 4 obitan s của 4 nguyên tử H để tạo thành 4 liên kết \(\sigma \) giữa C – H.
Sơ đồ:
Bài 4 trang 80 SGK Hóa học 10 Nâng cao
Mô tả sự hình thành liên kết trong các phân tử \({H_2}O,N{H_3}\) nhờ sự lai hóa \(s{p^3}\) các AO hóa trị của các nguyên tử O và N. Hãy mô tả hình dạng của các phân tử đó.
Giải
Phân tử \({H_2}O\):
- Một obitan 2s và 3 obitan 2p của nguyên tử O lai hóa với nhau tạo nên 4 obitan lai hóa \(s{p^3}\), giống hệt nhau, hướng về 4 đỉnh của hình tứ diện đều. Trên 2 obitan lai hóa có electron độc thân; còn trên hai obitan lai hóa khác có cặp electron ghép đôi.
- Hai electron lai hóa chứa electron độc thân xen phủ với obitan 1s chứa electron độc thân của hai nguyên tử hiđro, tạo nên 2 liên kết \(\sigma \).
- Phân tử \({H_2}O\) có dạng góc.
Phân tử \(N{H_3}\):
- 1 obitan 2s và 3 obitan 2p của nguyên tử N lai hóa với nhau tạo nên 4 obitan lai hóa \(s{p^3}\), giống hệt nhau, hướng về 4 đỉnh của hình tứ diện đều. Trên 3 obitan lai hóa có electron độc thân. Trên obitan lai hóa còn lại có cặp electron ghép đôi.
- 3 obitan lai hóa chứa electron độc thân xen phủ với 3 obitan 1s chứa electron độc thân của 3 nguyên tử hiđro, tạo nên 3 liên kết \(\sigma \).
- Phân tử \(N{H_3}\) có dạng hình chóp tam giác.
Bài 5 trang 80 SGK Hóa học 10 Nâng cao
Thế nào là sự xen phủ trục và xen phủ bên? Lấy thí dụ minh họa.
Giải
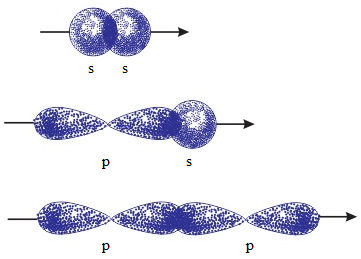
- Sự xen phủ trục: Sự xen phủ trong đó trục của các obitan tham gia liên kết trùng với đường nối tâm của hai nguyên tử liên kết gọi là sự xen phủ trục. Sự xen phủ trục tạo liên kết \(\sigma \).
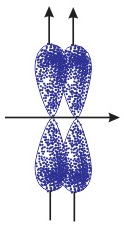
- Sự xen phủ bên: Sự xen phủ trong đó trục của các obitan tham gia liên kết song song với nhau và vuông góc với đường nối tâm của 2 nguyên tử liên kết được gọi là sự xen phủ bên. Sự xen phủ bên tạo liên kết \(\pi \).
Bài 6 trang 80 SGK Hóa học 10 Nâng cao
Thế nào là liên kết \(\sigma \), liên kết \(\pi \) và nêu tính chất của chúng.
Giải
a) Liên kết \(\sigma \):
- Liên kết \(\sigma \) được hình thành do sự xen phủ giữa hai obitan hóa trị của hai nguyên tử tham gia liên kết dọc theo trục liên kết.
- Tính chất của liên kết \(\sigma \) là đối xứng qua trục liên kết, các nguyên tử tham gia liên kết quay quanh trục liên kết. Liên kết \(\sigma \) bền hơn các loại liên kết khác.
b) Liên kết \(\pi \):
- Liên kết \(\pi \) là liên kết được hình thành do sự xen phủ giữa hai obitan hóa trị của 2 nguyên tử tham gia liên kết ở hai bên trục liên kết (xen phủ bên).
- Tính chất của liên kết \(\pi \) là không có tính đối xứng trục, nên hai nguyên tử tham gia liên kết không có khả năng quay quanh trục liên kết và kém bền hơn các liên kết khác.
Bài 7 trang 80 SGK Hóa học 10 Nâng cao
Thế nào là liên kết đơn? Liên kết đôi? Liên kết ba? Cho thí dụ.
Giải
- Liên kết đơn là liên kết do sự xen phủ 2 obitan liên kết theo dọc trục liên kết. Ví dụ: Phân tử HBr: H – Br.
- Liên kết đôi là liên kết được hình thành do 2 cặp electron liên kết. Trong liên kết đôi có 1 liên kết \(\sigma \) (bền hơn) và 1 liên kết \(\pi \) (kém bền hơn). Ví dụ: Phân tử CO: C = O.
- Liên kết ba là liên kết được hình thành do 3 cặp electron liên kết. Trong liên kết ba có 1 liên kết \(\sigma \) và 2 liên kết \(\pi \). Ví dụ: Phân tử axetilen: \(H - C \equiv C - H\).
Bài 8 trang 80 SGK Hóa học 10 Nâng cao
Mô tả sự hình thành các liên kết trong phân tử \(HCl,{C_2}{H_4},C{O_2},{N_2}.\)
Giải
- Phân tử HCl: Obitan 1s chứa electron độc thân của nguyên tử hiđro xen phủ với obitan 3p chứa electron độc thân của nguyên tử clo, tạo thành một liên kết \(\sigma \).
- Phân tử \({C_2}{H_4}\): Trong phân tử etilen \(\left( {{C_2}{H_4}} \right)\) mỗi nguyên tử cacbon có sự lai hóa \(s{p^2}\). Các obitan lai hóa tạo thành 1 liên kết \(\sigma \) giữa 2 nguyên tử cacbon và hai liên kết \(\sigma \) giữa hai nguyên tử hiđro. Mỗi nguyên tử cacbon còn một obitan p không tham gia lai hóa sẽ xen phủ bên với nhau tạo liên kết \(\pi \). Liên kết giữa hai nguyên tử cacbon là liên kết đôi.
- Phân tử \(C{O_2}\): Phân tử \(C{O_2}\) có dạng đường thẳng, nguyên tử cacbon lai hóa sp. Hai obitan lai hóa chứa electron độc thân của nguyên tử cacbon xen phủ trục với 2 obitan 2p chứa electron độc thân của 2 nguyên tử oxi, tạo thành 2 liên kết \(\sigma \). Hai obitan 2p không lai hóa của nguyên tử cacbon có chứa electron độc thân xen phủ bên với 2 obitan 2p chứa electron độc thân còn lại của 2 nguyên tử oxi, tạo nên 2 liên kết \(\pi \).
- Phân tử \({N_2}:\) Mỗi nguyên tử nitơ có 3 electron độc thân nằm trên 3 obitan 2p; 2 obitan 2p của hai nguyên tử nitơ xen phủ trục, tạo nên 1 liên kết \(\sigma \). Các obitan p còn lại xen phủ bên với nhau từng đôi một tạo nên 2 liên kết \(\pi \). Như vậy, 2 nguyên tử nitơ liên kết với nhau bằng 1 liên kết \(\sigma \) và 2 liên kết \(\pi \).
Giaibaitap.me
Giải bài tập trang 82 bài 19 Luyện tập về: Liên kết ion. Liên kết cộng hóa trị. Sự lai hóa các obitan nguyên tử Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Trình bày nội dung các quy tắc bát tử. ...
Giải bài tập trang 85 bài 20 Tinh thể nguyên tử. Tinh thể phân tử Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Tìm câu sai...
Giải bài tập trang 87 bài 21 Hiệu độ âm điện và liên kết hóa học Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Chọn câu đúng trong các câu sau...
Giải bài tập trang 90 bài 22 Hóa trị và số oxi hóa Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Số oxi hóa của nitơ trong...
