Bài 6 trang 191 SGK Hóa học 10 Nâng cao
Trong phòng thí nghiệm, người ta có thể điều chế khí clo bằng những phản ứng sau:
a) Dùng MnO2 oxi hóa dung dịch HCl đặc.
b) Dùng KMnO4 oxi hóa dung dịch HCl đặc.
c) Dùng H2SO4 đặc tác dụng với hỗn hợp NaCl và MnO2.
Hãy viết các phương trình hóa học.
Giải
Các phương trình phản ứng điều chế khí clo trong phòng thí nghiệm:
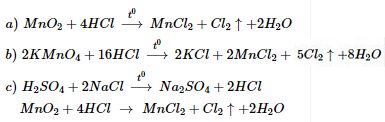
Bài 7 trang 191 SGK Hóa học 10 Nâng cao
Những hiđro halogenua nào có thể điều chế được khi cho axit sunfuric đặc tắc dụng lần lượt với các muối:
a) Natri florua;
b) Natri clorua;
c) Natri bromua;
d) Natri iotua.
Giải thích và viết phương trình hóa học.
Giải
Những hiđro halogenua sau có thể điều chế được khi cho H2SO4 đặc tác dụng với muối.
a) Natri florua: \({H_2}S{O_4} + 2NaF\,\, \to \,\,2HF + N{a_2}S{O_4}\)
b) Natri clorua: \(\eqalign{ & {H_2}S{O_4} + NaCl\buildrel {{t^0} < {{250}^0}C} \over \longrightarrow NaHS{O_4} + HCl \cr & {H_2}S{O_4} + 2NaCl\buildrel {{t^0} > {{400}^0}C} \over \longrightarrow N{a_2}S{O_4} + 2HCl \cr} \)
Những phản ứng của H2SO4 đặc trưng tác dụng với các muối NaBr, NaI không thể điều chế được HBr, HI vì \(\eqalign{ & 2NaBr + {H_2}S{O_{4\,đặc}}\,\, \to \,\,N{a_2}S{O_4} + 2HBr \cr & 2HBr + {H_2}S{O_{4\,đặc}}\,\, \to \,\,B{r_2} + S{O_2} \uparrow + 2{H_2}O \cr & 2NaI + {H_2}S{O_{4\,đặc}}\,\, \to \,\,N{a_2}S{O_4} + 2HI \cr & 8HI + {H_2}S{O_{4\,đặc}}\,\, \to \,\,4{I_2} + {H_2}S + 4{H_2}O \cr} \)
Chú ý : \(\mathrel{\mathop{\kern0pt\longrightarrow}\limits_\text{Tính khử và tính axit đều tăng}^{HF,HCl,HBr,HI}} \)
Bài 8 trang 191 SGK Hóa học 10 Nâng cao
Một bình đựng oxi ở nhiệt độ t0C áp suất P1 (atm), sau khi phóng tia lửa điện để chuyển oxi thành ozon bình được đưa về nhiệt độ ban đầu, áp suất khí trong bình lúc này là P2. Tiếp tục dẫn khí trong bình qua dung dịch KI (dư), thu được dung dịch A và 2,2848 lít khí (điều kiện tiêu chuẩn).
a) Tính hiệu suất của quá trình ozon hóa. Biết rằng để trung hòa dung dịch A cần dùng 150 ml dung dịch H2SO4 0,08M.
b) Tính P2 theo P1.
Giải
a)
\(\eqalign{ & {n_{{H_2}S{O_4}}} = 0,15.0,08 = 0,012\,\,\left( {mol} \right) \cr & {n_{{O_2}\,dư}} + {n_{{O_2}\,mới\,\sinh }} = {{2,2848} \over {22,4}} = 0,102\,\left( {mol} \right) \cr & {H_2}S{O_4} + 2KOH\,\, \to \,\,{K_2}S{O_4} + 2{H_2}O\,\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right) \cr & \,0,012\,\, \to 0,024 \cr & {O_3}\,\,\,\,\,\, + 2KI + {H_2}O\,\, \to \,\,2KOH + {I_2} + {O_2} \uparrow \,\,\,\left( 2 \right) \cr & 0,012\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \leftarrow \,\,\,\,\;\;\;\;\;\;0,024\,\,\,\,\,\, \to \,\,\,\;0,012 \cr & \,\,\,3{O_2}\,\,\buildrel {tia\,lửa\,điện} \over \longrightarrow \,\,2{O_3} \cr & 0,018\,\,\,\,\,\,\,\,\,\, \leftarrow \,\,\,\,\,\,\,\,\,\,0,012 \cr & {n_{{O_{2\,}}ban\,đầu}} = 0,018 + 0,102 - 0,012 = 0,108 \;{mol} \cr} \)
Vậy hiệu suất phản ứng là: \(H\% = {{0,018} \over {0,108}}.100 = 16,67\% \)
b) Bình kín và nhiệt độ không đổi ta có: \({{{P_1}} \over {{P_2}}} = {{{n_1}} \over {{n_2}}} = {{0,108} \over {0,102}} \Rightarrow {P_2} = 0,944{P_1}\)
Bài 9 trang 191 SGK Hóa học 10 Nâng cao
Oleum là gì?
a) Hãy xác định công thức của oleum A, biết rằng sau khi hòa tan 3,38 g A vào nước, người ta phải dùng 800ml dung dịch KOH 0,1M để trung hòa dung dịch A.
b) Cần hòa tan bao nhiêu gam oleum A vào 200g nước để được dung dịch H2SO4 10%.
Giải
Oleum là dung dịch \({H_2}S{O_4}\,\,98\% \) hấp thụ SO3 được oleum H2SO4.nSO3.
\({H_2}S{O_4} + nS{O_3}\,\, \to \,\,{H_2}S{O_4}.nS{O_3}\)
a) Xác định công thức oleum.
\(\eqalign{ & {H_2}S{O_4} + 2KOH\,\, \to \,\,{K_2}S{O_4} + 2{H_2}O\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right) \cr & 0,04\,\,\,\,\,\, \leftarrow \,\,0,08 \cr} \)
Ta có nKOH = 0,8.0,1 = 0,08 (mol)
Khi hòa tan oleum vào nước có quá trình
\({H_2}S{O_4}.nS{O_3} + n{H_2}O\,\, \to \,\,\left( {n + 1} \right){H_2}S{O_4}\,\,\,\,\,\,\,\left( 2 \right)\)
Từ (2) và đề bài ta có \({{98 + 80n} \over {3,38}} = {{n + 1} \over {0,04}}\)
Giải ra được n = 3. Vậy công thức phân tử oleum là H2SO4.3SO3.
b) Gọi a là số mol oleum H2SO4.3SO3.
Moleum = 98 + 240=338u \( \Rightarrow {m_{oleum}} = 338a\)
Khi hòa tan oleum vào nước có phản ứng sau:
\(\eqalign{ & {H_2}S{O_4}.3S{O_3} + 3{H_2}O\,\, \to \,\,4{H_2}S{O_4} \cr & \,\,\,\,\,\,\,1\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\;\;\;\;\;\;\;\;\;4 \cr & \,\,\,\,\,\,a\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\;\;\;\;\;\;\;\;\;4a \cr} \)
Khối lượng H2SO4 khi hòa tan a mol oleum: 98.4a = 392a
\({{392a} \over {338a + 200}} = {{10} \over {100}} \to a = 0,0558\,\,\left( {mol} \right)\)
Vậy mOleum phải dùng = \(338.0,0558 = 18,86 \) (gam).
Bài 10 trang 191 SGK Hóa học 10 Nâng cao
Nung 81,95 g hỗn hợp gồm KCl, KNO3 và KClO3 (xúc tác thích hợp) đến khi khối lượng không đổi. Sản phẩm khí sinh ra tác dụng với hiđro, thu được 14,4 g H2O. Sản phẩm rắn sinh ra được hòa tan trong nước rồi xử lí dung dịch này bằng dung dịch AgNO3, sinh ra 100,45 g AgCl kết tủa.
a) Viết các phương trình hóa học.
b) Xác định khối lượng mỗi muối trong hỗn hợp ban đầu.
Giải
a) KClO3 và KNO3 bị nhiệt phân.
\(\eqalign{ & 2KCl{O_3}\,\,\buildrel {{t^0}} \over \longrightarrow \,\,2KCl + 3{O_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 1 \right) \cr & \,\,\,\,\,\,\,x\,\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,x\,\,\, \to \,\,1,5x \cr & 2KN{O_3}\,\,\buildrel {{t^0}} \over \longrightarrow \,\,2KN{O_2} + {O_2}\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 2 \right) \cr & \,\,\,\,\,\,\,y\,\,\,\,\,\,\,\,\,\,\,\,\, \to \,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,0,5y \cr & 2{H_2} + {O_2}\,\, \to \,\,2{H_2}O\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\left( 3 \right) \cr & \,\,\,\,\,\,\,\,\,\,\,\,\,\,0,4\,\, \leftarrow \,\,0,8 \cr & KCl + AgN{O_3}\,\, \to \,\,AgCl \downarrow + KN{O_3}\,\,\,\,\,\,\left( 4 \right) \cr & \,0,7\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\,\, \leftarrow \,\,\,\,0,7 \cr} \)
b) Số mol H2O 0,8 mol; số mol AgCl 0,7 mol.
Đặt số mol KClO3, KNO3 và KCl lần lượt là x mol, y mol và z mol
\( \Rightarrow 122,5x + 101y + 74,5z = 81,95\,\,\,\left( * \right)\)
Từ (1), (2) và (3) \( \Rightarrow 1,5x + 0,5y = 0,4\,\,\left( {**} \right)\)
Từ (4) \( \Rightarrow {n_{KCl}} = 0,7 = x + z\,\,\left( {***} \right)\)
Giải hệ (*), (**), (***) ta được \(x = y = 0,2, z = 0,5\).
Vậy \({m_{KCl{O_3}}} = 24,5\,gam;\)
\({m_{KN{O_3}}} = 20,2\,gam\)
\({m_{KCl}} = 37,25\,gam.\)
Giaibaitap.me
Giải bài tập trang 202 bài 49 Tốc độ phản ứng hóa học Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Ý nào sau đây là đúng...
Giải bài tập trang 202, 203 bài 49 Tốc độ phản ứng hóa học Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 6: Hãy cho biết người ta lợi dụng yếu tố nào để tăng tốc độ phản ứng trong các trường hợp sau...
Giải bài tập trang 212, 213 bài 50 cân bằng hóa học Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1:
Giải bài tập trang 213 bài 50 cân bằng hóa học Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 6: Xét các hệ cân bằng sau trong một bình kín...
