Bài 6 - Trang 139 - SGK Hóa Học 10
a)Bằng phản ứng hóa học nào có thể chuyển hóa lưu huỳnh thành lưu huỳnh đioxit và ngược lại lưu huỳnh đioxit thành lưu huỳnh ?
b) Khí lưu huỳnh đioxit là khí chủ yếu gây mưa axit. Mưa axit phá hủy những công trình được xây dựng bằng đá, thép.
Tính chất nào của SO2 đã hủy hoại những công trình này ? Hãy dẫn ra những phản ứng hóa học để chứng minh.
Lời giải.
a) S + O2 -> SO2 (dựa vào tính khử của S).
SO2 + H2S -> 3S + 2H2O (dựa vào tính oxi hóa của SO2).
b) Tính khử của SO2.
SO2 do nhà máy thải vào khí quyển. Nhờ xúc tác là oxit kim loại trong khói bụi nhà máy, nó bị O2 của không khí oxi hóa thành SO3
2SO2 + O2 -> 2SO3
SO3 tác dụng với nước mưa tạo thành mưa axit tạo ra H2SO4. Tính axit của H2SO4 đã phá hủy những công trình được xây dựng bằng đá, thép.
Bài 7 - Trang 139 - SGK Hóa Học 10
Hãy dẫn ra những phản ứng hóa học chứng minh rằng lưu huỳnh đi oxit và lưu huỳnh trioxit là những oxit axit.
Lời giải.
SO2 và SO3 là các oxit axit vì:
- SO2 và SO3 tan trong nước tạo thành dung dịch axit.
SO2 + H2O 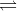 H2SO3
H2SO3
SO3 + H2O -> H2SO4
SO2 và SO3 tác dụng với bazơ , oxit bazơ để tạo muối sunfit và sunfat.
SO2 + NaOH -> NaHSO3
SO2 + 2NaOH -> Na2SO3 + H2O
SO3 + NaOH -> NaHSO4
SO3 + 2NaOH -> Na2SO4 + H2O.
SO2 + CaO -> CaSO3
SO3 + MgO -> MgSO4.
Bài 8 - Trang 139 - SGK Hóa Học 10
Cho hỗn hợp gồm Fe và FeS tác dụng với dung dịch HCl (dư), thu được 2,464 lít hỗn hợp khí (đktc). Cho hỗn hợp khí này đi qua dung dịch Pb(NO3)2 (dư) thu được 23,9 gam kết tủa màu đen.
a) Viết các phương trình phản ứng.
b) Hỗn hợp khí thu được gồm những khí nào ? Thể tích mỗi khí là bao nhiêu (đktc) ?
c) Tính khối lượng của Fe và Fe trong hỗn hợp ban đầu.
Lời giải.
a) Phương trình hóa học của phản ứng.
Fe + 2HCl -> FeCl2 + H2
x mol x mol.
FeS + 2HCL -> FeCl2 + H2S
ymol y mol
H2S + Pb(NO3)2 -> PbS + 2HNO3
0,1 0,1
b) Ta có nhh khí = \(\frac{2,464}{22,4}=0,11\) (mol), \(n_{PbS}=\frac{23,9}{239}=0,1\) (mol).
Hỗn hợp khí thu được là H2 và H2S.
Theo phương trình phản ứng hóa học trên ta có : \(\left\{\begin{matrix} x+y=0,11 & \\ y =n _{H_{2}S}=0,1 & \end{matrix}\right.\)
=> x = 0,01 (mol).
Vậy \(V_{H_{2}}=\) 0,01. 22,4 = 0,224 (lít), \(V_{H_{2}S}=\) 0,1. 22,4 = 2,24 (lít).
c) mFe = 56.0,01 = 0,56g ; mFeS = 0,1.88 = 8,8g.
Bài 9 - Trang 139 - SGK Hóa Học 10
Đốt cháy hoàn toàn 2,04 gam hợp chất A, thu được 1,08 g H2O và 1,344 l SO2 (đktc).
a) Hãy xác định công thức phân tử của hợp chất A.
b) Dẫn toàn bộ lượng hợp chất A nói trên qua dung dịch axit sunfuric đặc thấy có kết tủa màu vàng xuất hiện :
- Hãy giải thích hiện tượng và viết các phương trình phản ứng xảy ra.
- Tính khối lượng kết tủa thu được.
Lời giải.
a) Xác định công thức phân tử của hợp chất A.
\(n_{SO_{2}}=\frac{1,344}{22,4}=0,06\) => mS = 1,92 gam
\(n_{H_{2}O}=\frac{1,08}{18}=0,06\) => mH = 0,12 gam.
Như vậy hợp chất A chỉ gồm hai nguyên tố H và S.
Đặt công thức của hợp chất A là HxSy.
Ta có tỉ lệ y : x = 0,06 : 0,12 = 1 : 2.
Vậy công thức phân tử của A là H2S.
b) Phương trình hóa học của phản ứng.
3H2S + H2SO4 -> 4S + 4H2O
0,06 -> 0,08 (mol)
\(n_{H_{2}S}=\frac{2,04}{34}=0,06\) (mol)
Vậy mS = 0,08.32 = 2,56g.
Bài 10 - Trang 139 - SGK Hóa Học 10
Hấp thụ hoàn toàn 12,8g SO2 vào 250 ml dung dịch NaOH 1M.
a) Viết các phương trình hóa học của các phản ứng có thể xảy ra.
b) Tính khối lượng muối tạo thành sau phản ứng.
Lời giải.
\(n_{SO_{2}}=\frac{12,8}{64}=0,2\) (mol), \(n_{NaOH}=\frac{1.250}{1000}=0,25\) (mol).
a) Phương trình hóa học của phản ứng.
SO2 + NaOH -> NaHSO4
x x x (mol)
SO2 + 2NaOH -> Na2SO3 + H2O
y 2y y
Như ta đã biết :
1 ≤ \(\frac{n_{NaOH}}{n_{SO_{2}}}\) ≤ 2 ; 1 ≤ \(\frac{0,25}{0,2}\) ≤ 2
\(\left\{\begin{matrix} x+y=0,2 & \\ x+2y=0,25& \end{matrix}\right.\). Giải ra ta có : x = 0,15, y = 0,05
\(m_{NaHSO_{3}}=\) 0,15.104 = 15,6 (gam) ; \(m_{Na_{2}SO_{3}}=\) 0,5 . 126 = 6,3 (gam).
Giaibaitap.me
Giải bài 1, 2, 3, 4, 5, 6 trang 143 bài 33 Axit sunfuric - Muối sunfat Sách giáo khoa (SGK) Hóa học 10. Câu 1: Một hợp chất có thành phần theo khối lượng ...
Giải bài tập trang 147 bài 34 Luyện tập: Oxi và lưu huỳnh Sách giáo khoa (SGK) Hóa học 10. Câu 1: Cho phương trình hóa học...
Giải bài tập trang 154 bài 36: Tốc độ phản ứng hóa học Sách giáo khoa (SGK) Hóa học 10. Câu 1: Ý nào trong các ý sau đây là đúng...
Giải bài tập trang 162 bài 38 Cân bằng hóa học Sách giáo khoa (SGK) Hóa học 10. Câu 1: Ý nào sau đây là đúng...
