Bài 1 trang 166 SGK hóa học 10
Nội dung nào thể hiện trong các câu sau đây là sai:
A. Nhiên liệu cháy ở tầng khí quyển trên cao nhanh hơn khi cháy ở mặt đất.
B. Nước giải khát được nén CO2 vào ở áp suất cao hơn sẽ có độ chua (độ axit) lớn hơn.
C. Thực phẩm được bảo quản ở nhiệt độ thấp hơn sẽ giữ được lâu hơn.
D. Than cháy trong oxi nguyên chất nhanh hơn khi cháy trong không khí.
Lời giải.
Nội dung thể hiện trong câu sai là A.
Bài 2 trang 167 SGK hóa học 10
Cho biết cân bằng sau được thực hiện trong bình kín:
PCl5(k) \(\rightleftharpoons\) PCl3(k) +Cl2, ∆H > 0
Yếu tố nào sau đây tạo nên dự tăng lượng PCl3 trong cân bằng?
A. Lấy bớt PCl5 ra. B. Thêm Cl2 vào.
C. Giảm nhiệt độ. D.Tăng nhiệt độ.
Trả lời.
D đúng.
Bài 3 trang 167 SGK hóa học 10
Có thể dùng những biện pháp gì để tăng tốc độ của phản ứng xảy ra chậm ở điều kiện thường?
Lời giải.
Những biện pháp để tăng tốc độ của phản ứng xảy ra chậm ở điều kiện thường:
a) Tăng nồng độ chất phản ứng.
b) Tăng nhiệt độ tham gia phản ứng.
c) Kích thước hạt giảm (với phản ứng có chất rắn tham gia), tốc độ phản ứng tăng.
d) Cho thêm chất xúc tác với phản ứng cần chất xúc tác. Chất xúc tác là chất làm tăng tốc độ phản ứng, nhưng không bị tiêu hao trong phản ứng.
Bài 4 trang 167 SGK hóa học 10
Trong các cặp phản ứng sau, phản ứng nào có tốc độ lớn hơn?
a) Fe + CuSO4 (2M) và Fe + CuSO4 (4M)
b) Zn + CuSO4 (2M, 250C) và Zn + CuSO4 (2M,500C)
c) Zn(hạt) + CuSO4 (2M) và Zn(bột) + CuSO4 (2M)
d) 2H2 + O2 \(\overset{t^{o}thuong}{\rightarrow}\) 2H2O và 2H2 + O2 \(\xrightarrow[Pt]{t^{o}thuong}\) 2H2O
(Nếu không có gì thêm là so sánh trong cùng điều kiện).
Lời giải.
Những phản ứng có tốc độ lớn hơn:
a) Fe + CuSO4 (4M)
b) Zn + CuSO4 (2M,500C)
c) Zn(bột) + CuSO4 (2M)
d) 2H2 + O2 \(\xrightarrow[Pt]{t^{o}thuong}\) 2H2O
Bài 5 trang 167 SGK hóa học 10
Cho biết phản ứng thuận nghịch sau:
2NaHCO3(r) \(\rightleftharpoons\) Na2CO3(r) + CO2(k) + H2O(k), ∆H > 0
Có thể dùng những biện pháp gì để chuyển hóa nhanh và hoàn toàn NaHCO3 thành Na2CO3?
Lời giải.
Những biện pháp để chuyển hóa nhanh và hoàn toàn NaHCO3 thành Na2CO3: Đun nóng, hút ra ngoài CO2, H2O.
Bài 6 trang 167 SGK hóa học 10
Hệ cân bằng sau xảy ra trong một bình kín:
CaCO3(r) 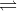 CaO(r) + CO2(k), ∆H > 0
CaO(r) + CO2(k), ∆H > 0
Điều gì sẽ xảy ra nếu thực hiện một trong những biến đổi sau?
a) Tăng dung tích của bình phản ứng lên.
b) Thêm CaCO3 vào bình phản ứng.
c) Lấy bớt CaO khỏi bình phản ứng.
d) Thêm ít giọt NaOH vào bình phản ứng.
e) Tăng nhiệt độ.
Lời giải.
Điều sẽ xảy ra nếu:
a) Tăng dung tích của bình phản ứng lên: Áp suất chung giảm, cân bằng dịch chuyển theo chiều thuận.
b) Thêm CaCO3 vào bình phản ứng: Chất rắn không ảnh hưởng đến dịch chuyển cân bằng.
c) Lấy bớt CaO khỏi bình phản ứng: Chất rắn không ảnh hưởng đến dịch chuyển cân bằng.
d) Thêm ít giọt NaOH vào bình phản ứng: Xảy ra phản ứng với CO2 làm giảm nồng độ của chất khí này . Do đó, cân bằng chuyển dịch theo chiều thuận.
e) Tăng nhiệt độ: Cân bằng hóa học chuyển dịch theo chiều thuận để chống lại sự tăng nhiệt độ.
Bài 7 trang 167 SGK hóa học 10
Trong số các cân bằng sau, cân bằng nào sẽ chuyển dịch và dịch chuyển theo chiều nào khi giảm dung tích của bình phản ứng xuống ở nhiệt độ không đổi:
a) CH4(k) + H2O(k) \(\rightleftharpoons\) CO(k) + 3H2(k)
b) CO2(k) + H2(k) \(\rightleftharpoons\) CO(k) + H2O(k)
c) 2SO2(k) + O2(k) \(\rightleftharpoons\) 2SO3(k)
d) 2HI \(\rightleftharpoons\) H2(k) + I2(k)
e) N2O4(k) \(\rightleftharpoons\) 2NO2(k)
Lời giải.
Giảm dung tích của bình phản ứng xuống ở nhiệt độ không đổi, tức là tăng áp suất của bình nên:
a) Cân bằng chuyển dịch theo chiều nghịch.
b) Cân bằng không chuyển dịch.
c) Cân bằng chuyển dịch theo chiều thuận.
d) Cân bằng không chuyển dịch.
e) Cân bằng chuyển dịch theo chiều nghịch.
Giaibaitap.me
