Bài 5.45 trang 53 Sách bài tập (SBT) Hóa học 10
Tại sao có thể dùng bình thép đựng khí clo khô mà không được dùng bình thép đựng khí clo ẩm ?
Lời giải:
ở điều kiện thường, khí clo khô không tác dụng với sắt. Nếu có nước, clo tác dụng với nước tạo ra axit ăn mòn bình thép.
Dùng bình thép khô chứa \(Cl_2\) vì
\(Fe + Cl_2\) khô → \(Fe + Cl_2\) khô → không phản ứng ở nhiệt độ thường
Không được dùng bình thép ẩm chứa khí \(Cl_2\)
\(Cl_2 + H_2O\) → HCl +HClO
Bài 5.46 trang 53 Sách bài tập (SBT) Hóa học 10
Đưa một bình cầu đựng 250 gam nước clo ra ngoài ánh sáng mặt trời thì có 0,112 lít (đktc) khí được giải phóng. Hỏi khí nào được giải phóng ? Tính nồng độ % của clo trong dung dịch đầu, cho rằng tất cả clo tan trong nước, đã phản ứng với nước.
Lời giải:
Khi được giải phóng là \(O_2\)
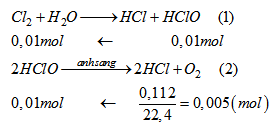
Từ (1) và (2) suy ra:
\(\begin{array}{l}
{n_{C{l_2}}} = 0,01\left( {mol} \right)\\
C{\% _{\left( {Clo} \right)}} = \frac{{71.0,01}}{{250}}.100\% = 0,284\%
\end{array}\)
Bài 5.47 trang 53 Sách bài tập (SBT) Hóa học 10
Cho 17,4 gam \(MnO_2\) tác dụng hết với dung dịch HCl. Toàn bộ khí cu sinh ra được hấp thụ hết vào 145,8 gam dung dịch NaOH 20% ở nhiệt độ thường tạo ra dung dịch A. Hỏi dung dịch A có chứa những chất tan nào ? Tính nồng độ % của từng chất tan đó.
Lời giải:
\(\begin{array}{l}
Mn{O_2} + 4HCl \to MnC{l_2} + C{l_2} + 2{H_2}O\\
C{l_2} + 2NaOH \to NaCl + NaClO + {H_2}O
\end{array}\)
\({n_{C{l_2}}} = {n_{Mn{O_2}}} = \frac{{17,4}}{{87}} = 0,2\,mol\)
(C% NaOH = mct / mdd x 100% => \(m_{ct}\) = C% NaOH x mdd / 100% = 20% x 145,8 / 100% = 29,16 (g)
n NaOH = mct / M NaOH = 29,16 / 40 = 0,729 (mol)
\(Cl_2\) + 2NaOH --> NaCl + NaClO + \(H_2O\)
Trước pứ:0,2___0,729
Trong pứ :0,2 ---> 0,4 -----------> 0,2 ------> 0,2 (mol)
Sau pứ__: 0 -----> 0,329 -------> 0,2 ------> 0,2 (mol)
Số mol các chất sau phản ứng
\(n_{NaOH}\) = 0,329 mol
\(n_{NaCl}\) = 0,2 mol
\(n_{NaClO}\)= 0,2 mol
Vậy chứa các chất sau NaOH dư , NaCl , NaClO
m Cl2 = 0,2.35,5 = 7,1 g
m Cl2 + m dd NaOH = 145,8 + 7,1 = 152,9 g
m NaOH = 40 . 0,329 = 13,16g
m NaCl = 0,2.58,5 = 11,7 g
m NaClO = 0,2.74,5 = 14,9 g
C% NaOH = mct / mdd x 100% = 13,16 / 152,9 x 100% = 8,6 %
C% NaCl = mct / mdd x 100% = 11,7 / 152,9 x 100% = 7,65 %
C% NaClO = mct / mdd x 100% = 14,9 / 152,9 x 100% = 9,74 %
Đáp số: NaCl:7,65%; NaClO:9,74%; NaOH:8,6%
Bài 5.48 trang 53 Sách bài tập (SBT) Hóa học 10
Trong phòng thí nghiệm có các hoá chất : \(NaCl, KMnO_4, NaOH, H_2O\), dung dịch \(H_2SO_4\) đặc. Viết PTHH của các phản ứng dùng để điều chế nước Gia-ven từ các chất trên.
Lời giải:
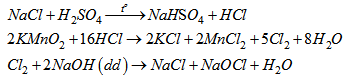
Giaibaitap.me
Giải bài tập trang 54 bài 25 Flo - Brom - Iot Sách bài tập Hóa học 10. Câu 5.52: Có hai nguyên tố halogen khi ở dạng đơn chất đều độc hại với cơ thể người...
Giải bài tập trang 54, 55 bài 25 Flo - Brom - Iot Sách bài tập (SBT) Hóa học 10. Câu 5.58: Xác định nồng độ phần trăm của dung dịch KBr ...
Giải bài tập trắc nghiệm trang 55 bài 26 Luyện tập : Nhóm halogen Sách bài tập Hóa học 10. Câu 5.65: Cho phản ứng ...
Giải bài tập trang 55 bài 26 Luyện tập : Nhóm halogen Sách bài tập Hóa học 10. Câu 5.70: Vì sao người ta có thể điều chế ...
