Bài 1 trang 34 SGK Hóa học 10 Nâng cao
Dãy nào trong các dãy sau đây gồm các phân lớp electron đã bão hòa?
A.\({s^1},{p^3},{d^7},{f^{12}}\) B. \({s^2},{p^5},{d^9},{f^{13}}.\)
C. \({s^2},{p^4},{d^{10}},{f^{11}}.\) D. \({s^2},{p^6},{d^{10}},{f^{14}}.\)
Giải
Chọn D.
Bài 2 trang 34 SGK Hóa học 10 Nâng cao
Cấu hình electron ở trạng thái cơ bản của nguyên tử kim loại nào sau đây có electron độc thân ở obitan s?
A. Crom B. Coban
C. Sắt D. Mangan
E. Niken
Giải
Cr (Z=24): \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^1 3d^5\)
Theo lý thuyết thì phải là \(4s^2 3d^4\) nhưng 1e ở \(4s^2\) đã nhảy vào \(3d^4\) để cấu hình đạt mức bán bão hòa vì vậy mà Crom có e độc thân ở phân lớp s (\(4s^1\))
Fe (Z=26) : \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^6\Rightarrow\) ko có
Mn (Z=25) : \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^5\Rightarrow\) ko có
Ni (Z=28) : \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2 3d^8\Rightarrow\) ko có
Bài 3 trang 34 SGK Hóa học 10 Nâng cao
Mức năng lượng của các obitan \(2{p_x},2{p_y}\) và \(2{p_z}\) có khác nhau không? Vì sao?
Giải
Năng lượng của các obitan \(2{p_x},2{p_y}\) và \(2{p_z}\) không khác nhau.
Vì phân lớp p có 3obitan trên cùng 1 phân lớp có mức năng lượng như nhau chỉ khác nhau về sự định hướng trong không gian.
Bài 4 trang 34 SGK Hóa học 10 Nâng cao
Hãy cho biết số electron tối đa:
a) Trong các lớp K, L, M, N.
b) Trong các phân lớp s, p, d, f.
Giải
a) Phân lớp K chứa tối đa 2 electron; phân lớp L chứa tối đa 8 electron, phân lớp M chứa tối đa 18 electron; phân lớp N chứa tối đa 32 electron.
b) Phân lớp s chứa tối đa 2 electron; phân lớp p chứa tối đa 6 electron, phân lớp d chứa tối đa 10 electron; phân lớp f chứa tối đa 14 electron.
Bài 5 trang 34 SGK Hóa học 10 Nâng cao
Sự phân bố các electron vào mỗi obitan nguyên tử ở trạng thái cơ bản sau có được viết đúng không? Hãy giải thích?
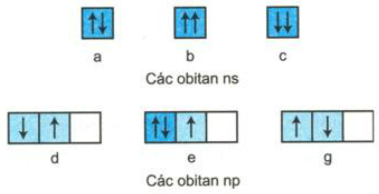
Giải
Ta có:
a) Viết đúng quy ước.
b) Không viết đúng quy ước
c) Không viết đúng quy ước
d) Không viết đúng quy ước
e) Viết đúng qui ước.
f) Không viết đúng qui ước.
Giải thích: Sự xắp xếp các electron vào các obitan theo dựa theo quy tắc Hun, nguyên lý Pau-li, nguyên lí bền vững.
Bài 6 trang 34 SGK Hóa học 10 Nâng cao
Khi số hiệu nguyên tử Z tăng, trật tự các mức năng lượng AO tăng dần theo chiều từ trái qua phải có đúng trật tự như dãy sau không?
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s 5d 6p 7s 5f 6d …
Giải
Khi số hiệu nguyên tử Z tăng, trật tự năng lượng AO tăng dần theo chiều từ trái qua phải và trật tự từ thấp lên cao theo dãy:
1s 2s 2p 3s 3p 3d 4s 4p 4d 4f 5s 5p 6s 5d 6p 7s 5f 6d … là sai
Sửa lại là: 1s 2s 2p 3s 3p 4s 3d 4p 5s 4d 5p 6s 4f 5d 6p 7s 5f 6d …
Bài 7 trang 34 SGK Hóa học 10 Nâng cao
Viết cấu hình electron nguyên tử của các nguyên tố có Z = 15 Z = 17, Z = 20, Z = 21, Z = 31.
Giải
Cấu hình e nguyên tử của các nguyên tố có:
Z = 15: \(1s^2 2s^2 2p^6 3s^2 3p^3\)
Z = 17: \(1s^2 2s^2 2p^6 3s^2 3p^5\)
Z = 20: \(1s^2 2s^2 2p^6 3s^2 3p^6 4s^2\)
Z = 21: \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^1 4s^2\)
Z = 31: \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^{10} 4s^2 4p^1\)
Bài 8 trang 34 SGK Hóa học 10 Nâng cao
Nguyên tử Fe có Z = 26. Hãy viết cấu hình electron của Fe
Nếu nguyên tử Fe bị mất hai electron, mất ba electron thì các cấu hình electron tương ứng sẽ như thế nào?
Giải
Fe (Z = 26): \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 4s^2\)
\(Fe^{2+}\) (Z = 26): \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^6 \)
\(Fe^{3+}\) (Z = 26): \(1s^2 2s^2 2p^6 3s^2 3p^6 3d^5\)
Giaibaitap.me
Giải bài tập trang 39 bài 9 Bảng tuần hoàn các nguyên tố hóa học Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Nguyên tử các nguyên tố xếp ở chu kì 6 có số lớp electron trong nguyên tử là...
Giải bài tập trang 49 bài 11 Sự biến đổi một số đại lượng vật lí của các nguyên tố hóa học Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Trong một chu kì, bán kính nguyên tử các nguyên tố...
Giải bài tập trang 55 bài 12 Sự biến đổi tính kim loại, tính phi kim của nguyên tố hóa học. Định luật tuần hoàn Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Cho biết quy luật biến đổi tính kim loại, tính phi kim của các nguyên tố trong một chu kì cad trong một nhóm A, giải thích...
Giải bài tập trang 57, 58 bài 13 Ý nghĩa của bảng tuần hoàn các nguyên tố hóa học Sách giáo khoa (SGK) Hóa học 10 Nâng cao. Câu 1: Theo quy luật biến đổi tính chất của các nguyên tố trong bảng tuần hoàn thì...
