Bài 1 SGK trang 125 hoá học 12 nâng cao
a, Phản ứng hoá học xảy ra trong pin điện hoá:
\(2Cr + 3C{u^{2 + }} \to2C{r^{3 + }} + 3Cu\)
\({{\rm E}^0}\) của pin điện hoá là:
A. \(0,40\;V\)
B. \(1,08\;V\)
C. \(1,25\;V\)
D. \(2.5\;V\)
Biết \({\rm E}_{C{u^{2 + }}/Cu}^0 = + 0,34V;{\rm E}_{C{r^{3 + }}/Cr}^0 = - 0,74V\)
b. Phản ứng hoá học xảy ra trong pin điện hoá:
\(2A{u^{3 + }} + 3Ni \to 2Au + 3N{i^{2 + }}\)
\({{\rm E}^0}\) của pin điện hoá là:
A. \(3,75\;V\)
B. \(2,25\;V\)
C. \(1,76\;V\)
D. \(1,25\;V\)
Giải:
a. Chọn B. \({\rm E}_{Pin}^0 = {\rm E}_{C{u^{2 + }}/Cu}^0 - {\rm E}_{C{r^{3 + }}/Cr}^0 = 0,34 - ( - 0,74) = 1,08V.\)
b. Chọn C. \({\rm E}_{Pin}^0 = {\rm E}_{A{u^{3 + }}/Au}^0 - {\rm E}_{N{i^{2 + }}/Ni}^0 = 1,5 - ( - 0,26) = 1,76V.\)
Bài 2 SGK trang 125 hoá học 12 nâng cao
a. Chất nào sau đây có thể oxi hoá \(Zn\) thành \(Z{n^{2 + }}\)?
\(\eqalign{
& A.Fe \cr
& B.A{g^ + } \cr
& C.A{l^{3 + }} \cr
& D.C{a^{2 + }}. \cr} \)
b. Kim loại \(Zn\) có thể khử được ion nào sau đây ?
\(\eqalign{
& A.N{a^ + } \cr
& B.{H^ + } \cr
& C.C{a^{2 + }} \cr
& D.M{g^{2 + }}. \cr} \)
Giải:
a. Chọn B.
b. Chọn B.
Bài 3 SGK trang 125 hoá học 12 nâng cao
Trong quá trình pin điện hoá \(Zn-Ag\) hoạt động, ta nhận thấy
A. Khối lượng của điện cực \(Zn\) tăng
B. Khối lượng của điện cực \(Ag\) giảm
C. Nồng độ của ion \(Z{n^{2 + }}\) trong dung dịch tăng.
D. Nồng độ của ion \(A{g^ + }\) trong dung dịch tăng.
Giải:
Chọn C
Bài 4 SGK trang 125 hoá học 12 nâng cao
Dưới đây là hình vẽ của 4 sơ đồ pin điện hoá chuẩn. Hãy chỉ ra những chỗ sai và sửa lại cho đúng.
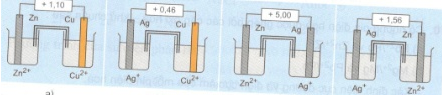
a) b) c) d)
Cho biết:
\(\eqalign{
& {\rm E}_{A{g^ + }/Ag}^0 = + 0,80V \cr
& {\rm E}_{C{u^{2 + }}/Cu}^0 = + 0,34V \cr
& {\rm E}_{Z{n^{2 + }}/Zn}^0 = - 0,76V \cr} \)
Giải:
- Sơ đồ a đúng, suất điện động chuẩn ghi đúng
- Sơ đồ b vẽ sai, suất điện động chuẩn ghi đúng
- Sơ đồ c vẽ đúng, suất điện động chuẩn ghi sai
- Sơ đồ d vẽ sai, suất điện động chuẩn ghi đúng.
Sửa lại:
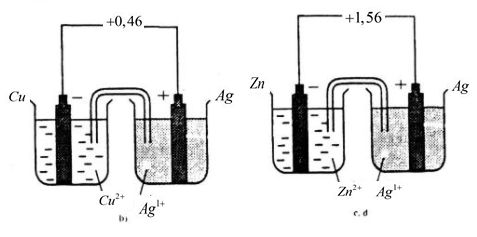
Bài 5 SGK trang 126 hoá học 12 nâng cao
Khi nhúng một lá \(Zn\) vào dung dịch muối \(C{o^{2 + }}\) thì thấy có một lớp kim loại \(Co\) phủ ngoài lá kẽm. Khi nhúng lá \(Pb\) vào dung dịch muối trên thì không thấy hiện tượng nào xảy ra.
a. Kim loại nào có tính khử mạnh nhất trong số 3 kim loại trên?
b. Cation nào có tính oxi hoá mạnh nhất trong số ba cation kim loại trên?
c. Sắp xếp các cặp oxi hoá – khử của những kim loại trên theo chiều tính oxi hoá của cation tăng dần.
d. Viết phương trình hoá học của phản ứng xảy ra giữa các cặp oxi hoá - khử.
Giải:
a. Kim loại có tính khử mạnh nhất là \(Zn\).
b. Cation có tính oxi hoá mạnh nhất là \(P{b^{2 + }}\).
c.
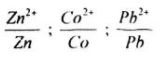
d. \(Zn + C{o^{2 + }} \to Z{n^{2 + }} + Co,\)
\(Zn + P{b^{2 + }} \to Z{n^{2 + }} + Pb,\)
\(Co + P{b^{2 + }} \to C{o^{2 + }} + Pb.\)
Bài 6 SGK trang 126 hóa học 12 nâng cao
Hãy giải thích hiện tượng thí nghiệm: Ngâm một lá \(Zn\) nhỏ, tinh khiết trong dung dịch \(HCl\) thấy bọt khí \({H_2}\) thoát ra ít và chậm. Nếu nhỏ thêm vài giọt dung dịch \(CuS{O_4}\) thấy bọt khí \({H_2}\) thoát ra nhiều và nhanh hơn.
Giải:
Ngâm một lá \(Zn\) nhỏ, tinh khiết trong dung dịch \(HCl\) thì xảy ra phản ứng:
\(Zn + 2HCl \to ZnC{l_2} + {H_2} \uparrow \)
Bọt khí \(H_2\) thoát ra ít và chậm là do \(H_2\) sinh ra trên bề mặt lá kẽm nên gây cản trở phản ứng.
Nếu nhỏ thêm vài giọt dung dịch \(CuSO_4\) thấy bọt khí \(H_2\) thoát ra rất nhiều và nhanh hơn, \(Zn\) bị hoà tan nhanh do có sự ăn mòn điện hoá
\(Zn + CuS{O_4} \to ZnS{O_4} + Cu \downarrow \)
Trong dung dịch \(HCl\), \(Zn\) là cực âm, \(Cu\) cực dương.
- Tại cực âm \(Zn\) bị oxi hoá
\(Zn\mathrel{\mathop{\kern0pt\longrightarrow}
\limits_{}} Z{n^{2 + }} + 2e\)
- Tại cực dương ion \({H^ + }\) bị khử:
\(2{H^ + } + 2e\mathrel{\mathop{\kern0pt\longrightarrow}
\limits_{}} {H_2} \uparrow \)
Bọt khí thoát ra nhiều và liên tục ở cực dương.
Bài 7 SGK trang 126 hoá học 12 nâng cao
Cho các cặp oxi hoá- khử sau: \(A{g^ + }/Ag;F{e^{2 + }}/Fe;Z{n^{2 + }}/Zn\)
a. Hãy viết phương trình của các cặp phản ứng chuyển đổi giữa cation kim loại và nguyên tử kim loại trong mỗi cặp.
b. Hãy cho biết trong các cặp oxi hoá-khử đã cho, chất nào có tính
- oxi hoá mạnh nhất
- oxi hoá yếu nhất
- khử mạnh nhất
- khử yếu nhất
Giải:
a) \(\eqalign{
& Fe + 2A{g^ + } \to F{e^{2 + }} + 2Ag \downarrow \cr
& Zn + 2A{g^ + } \to Z{n^{2 + }} + 2Ag \downarrow \cr
& Zn + F{e^{2 + }} \to Z{n^{2 + }} + Fe \downarrow \cr} \)
b)
- Oxi hoá mạnh nhất: \(A{g^ + }\)
- Oxi hoá yếu nhất: \(Z{n^{2 + }}\)
- Khử mạnh nhất: \(Zn\)
- Khử yếu nhất: \(Ag\).
Bài 8 SGK trang 126 hoá học 12 nâng cao
Hãy tính thế điện cực chuẩn của cặp oxi hoá – khử \({\rm E}_{Z{n^{2 + }}/Zn}^0.\) Biết rằng \({\rm E}_{Pin\left( {Zn - Cu} \right)}^0 = 1,10V\) và \({\rm E}_{C{u^{2 + }}/Cu}^0 = + 0,34V\).
Giải:
\(\eqalign{
& {\rm E}_{Pin\left( {Zn - Cu} \right)}^0 = {\rm E}_{C{u^{2 + }}/Cu}^0 - {\rm E}_{Z{n^{2 + }}/Zn}^0 \cr
& \Rightarrow {\rm E}_{Z{n^{2 + }}/Zn}^0 = {\rm E}_{C{u^{2 + }}/Cu}^0 - {\rm E}_{Pin\left( {Zn - Cu} \right)}^0 = 0,34 - \left( {1,10} \right) = - 0,76V. \cr} \)
Bài 9 SGK trang 126 hoá học 12 nâng cao
Có những pin điện hoá được tạo thành từ cặp oxi hoá- khử sau:
a. \(P{b^{2 + }}/Pb\) và \(F{e^{2 + }}/Fe\)
b. \(A{g^ + }/Ag\) và \(F{e^{2 + }}/Fe\)
c. \(A{g^ + }/Ag\) và \(P{b^{2 + }}/Pb\)
Tính suất điện động chuẩn của mỗi pin điện hoá.
Biết rằng: \({\rm E}_{A{g^ + }/Ag}^0 = + 0,80V;{\rm E}_{P{b^{2 + }}/Pb}^0 = - 0,13V;{\rm E}_{F{e^{2 + }}/Fe}^0 = - 0,44V\)
Giải :
\(\eqalign{
& a.{\rm E}_{Pin\left( {Fe - Pb} \right)}^0 = {\rm E}_{P{b^{2 + }}/Pb}^0 - {\rm E}_{F{e^{2 + }}/Fe}^0 = - 0,13 - ( - 0,44) = + 0,31V. \cr
& b.{\rm E}_{Pin\left( {Fe - Ag} \right)}^0 = {\rm E}_{A{g^ + }/Ag}^0 - {\rm E}_{F{e^{2 + }}/Fe}^0 = + 0,80 - ( - 0,44) = + 1,24V. \cr
& c.{\rm E}_{Pin\left( {Pb - Ag} \right)}^0 = {\rm E}_{A{g^ + }/Ag}^0 - {\rm E}_{P{b^{2 + }}/Pb}^0 = + 0,80 - ( - 0,13) = + 0,93V. \cr} \)
Bài 10 SGK trang 126 hoá học 12 nâng cao
Có những pin điện hoá được ghép bởi các cặp oxi hoá – khử chuẩn sau:
a. \(P{b^{2 + }}/Pb\) và \(Z{n^{2 + }}/Zn;\)
b. \(M{g^{2 + }}/Mg\) và \(P{b^{2 + }}/Pb\).
- Xác định điện cực dương và điện cực âm của mỗi pin điện hoá.
- Viết phương trình hoá học của phản ứng xảy ra ở các điện cực của mỗi pin và phương trình hoá học dạng ion thu gọn của mỗi pin điện hoá khi phóng điện,
- Xác định suất điện động chuẩn của các pin điện hoá trên.
Giải:
a. Cực âm \(Zn\) : \(Zn \to Z{n^{2 + }} + 2e.\)
Cực dương \(Pb\) : \(P{b^{2 + }} + 2e \to Pb.\)
Phương trình hoá học: \(Zn + P{b^{2 + }} \to Z{n^{2 + }} + Pb.\)
\({\rm E}_{Pin}^0 = {\rm E}_{P{b^{2 + }}/Pb}^0 - {\rm E}_{Z{n^{2 + }}/Zn}^0 = ( - 0,13) - ( - 0,76) = + 0,63\)
b. Cực âm \(Mg\) : \(Mg \to M{g^{2 + }} + 2e.\)
Cực dương \(Pb\) : \(P{b^{2 + }} + 2e \to Pb.\)
Phương trình hoá học: \(Mg + P{b^{2 + }} \to M{g^{2 + }} + Pb.\)
\({\rm E}_{Pin}^0 = {\rm E}_{P{b^{2 + }}/Pb}^0 - {\rm E}_{M{g^{2 + }}/Mg}^0 = ( - 0,13) - ( - 2,37) = + 2,24V.\)
Giaibaitap.me
Giải bài tập trang 131 bài 22 sự điện phân SGK Hoá học 12 Nâng cao. Câu 1: Phản ứng nào xảy ra ở catot trong quá trình điện phân...
Giải bài tập trang 136 bài 23 sự ăn mòn kim loại SGK Hoá học 12 Nâng cao. Câu 1: Bản chất của ăn mòn hóa học và ăn mòn điện hóa học có gì giống và khác nhau...
Giải bài tập trang 140 bài 24 điều chế kim loại SGK Hoá học 12 Nâng cao. Câu 1: Dãy ion kim loại nào sau đây đều bị Zn khử thành kim loại...
Giải bài tập trang 142, 143 bài 25 luyện tập sự điện phân - sự ăn mòn kim loại - điều chế kim loại SGK Hoá học 12 Nâng cao. Câu 1: Trong quá trình điện phân dung dịch ...
