Bài 9.6 trang 13 Sách bài tập (SBT) Hóa học 8
a) Tính khối lượng bằng gam của :
-6,02.1023 phân tử nước H20,
-6,02.1023 phân tử cacbon đioxit CO2,
-6,02.1023 phân tử canxi cacbonat CaCO3.
b) Nêu nhận xét về số trị của các giá trị khối lượng tính được này và số trị phân tử khối của mỗi chất.
(Xem lại bài tập 8.9*. trước khi làm bài tập này).
Trả lời
a) Khối lượng tính bằng gam của : 6,02.1023 phân từ nước (phân tử khối là 18 đvC) bằng :
6,02.1023 X 18 X 1,66 X 10-24 g.
= 18 X 6,02 X 1,66 X 1023 X 1024 g
≈ 18 X 10 X 1023 x 10-24 g
≈18 X 1024 x 10-24=18 g
Khối lượng tính bằng gam của 6,02. 1023 phân tử CO2
[phân tử khối bằng : 12 + 2 x 16 = 44 (đvC)] và cùa 6,02. 1023 phân tử CaCO ;
[phân tử khối bằng : 40 + 12 + 3 x 16 = 100 (đvC)] theo thứ tự bằng (đặt tính như trên) : 44 g và 100 g.
b) Số trị của các giá trị khối lượng tính được bằng chính số trị phân tử khối của mỗi chất.
Bài 9.7 trang 13 Sách bài tập (SBT) Hóa học 8
Thực nghiệm cho biết nguyên tố natri chiếm 59% về khối lượng trong hợp chất với nguyên tố lưu huỳnh.
Viết công thức hoá học và tính phân tử khối của hợp chất.
{Hướng dẫn : Để viết đúng công thức hoá học của hợp chất AxBy phải xác định được các chỉ số X, y. Biết rằng, tỉ lệ phần trăm về khối lượng giữa hai nguyên tố trong hợp chất bằng đúng tỉ lệ khối lượng giữa hai nguyên tố trong 1 phân tử. Từ đây có các tỉ lệ như sau :
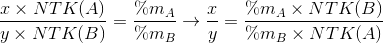
Tính và rút gọn thành tỉ lệ hai số nguyên đơn giản nhất, thông thường thì X, y là hai số nguyên này. Ngoài ra, nếu biết trước phân tử khối của AxBy thì xác định được chắc chắn X và y, không tính dựa theo tỉ lệ như trên).
Trả lời
Gọi công thức của hợp chất là 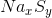 .Theo đè bài ta có
.Theo đè bài ta có
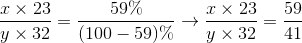
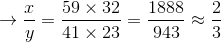
Công thức hóa học của hợp chất: 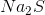
Phân tử khối bằng 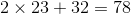 (đvC)
(đvC)
Bài 9.8 trang 13 Sách bài tập (SBT) Hóa học 8
Hợp chất A tạo bởi hai nguyên tố là nitơ và oxi. Người ta xác định được
rằng, tỉ lê khối lương giữa hai nguyên tố trong A bằng : 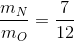
Viết công thức hoá học và tính phân tử khối của A.
(jHướng dẫn : Biết rằng, tỉ lệ khối lượng giữa hai nguyên tố trong hợp chất AxBy cũng bằng đúng tỉ lệ khối lượng giữa hai nguyên tố trong 1 phân tử. Vì vậy tiến hành tương tự như đã hướng dẫn ở bài tập 9.7*, chỉ khác là trong đó thay %mA bằng mA và %mB bằng mB).
Trả lời
Gọi công thức của A là 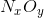 .Theo đề bài ta có
.Theo đề bài ta có
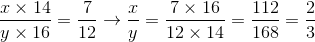
Vậy x=2, y=3.
Công thức hóa học của hợp chất 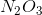
Phân tử khối bằng : 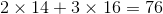 (đvC)
(đvC)
Giaibaitap.me
Giải bài tập trang 14 bài 10 hóa trị Sách bài tập (SBT) Hóa học 8. Câu 10.5: Tính hoá trị của mỗi nguyên tố trong công thức hoá học của các hợp chất sau, biết nhóm (NO3) hoá trị I và nhóm (CO3) hoá trị II...
Giải bài tập trang 14 bài 10 hóa trị Sách bài tập (SBT) Hóa học 8. Câu 10.1: Chép vào vở bài tập những câu sau đây với đầy đủ các từ hay cụm từ thích hợp chọn trong khung...
Giải bài tập trang 15, 16 bài ôn tập chương I Sách bài tập (SBT) Hóa học 8. Câu 11.1: Viết sơ đồ công thức các hợp chất sau...
Giải bài tập trang 15 bài 10 hóa trị Sách bài tập (SBT) Hóa học 8. Câu 10.8: Biết Cr (crom) có hai hoá trị thường gặp là II và III, hãy chọn những công thức hoá học đúng trong số các công thức cho sau đây...
