Bài 1 trang 75 sgk hóa học 8
Sắt tác dụng với axit clohiđric:
Fe + 2HCl → FeCl2 + H2.
Nếu có 2,8 g sắt tham gia phản ứng, em hãy tìm:
a) Thể tích khí hiđro thu được ở đktc.
b) Khối lượng axit clohiđric cần dùng.
Bài giải:
Số mol sắt tham gia phản ứng:
nFe = 0,05 mol
a) Thể tích khí hiđro thu được ở đktc:
Fe + 2HCl → FeCl2 + H2.
Theo phương trình hóa học, ta có: \(n_{H_{2}}\) = nFe = 0,05 mol
Thể tích khí thu được ở đktc là: \(V_{H_{2}}\) = 22,4 . n = 22,4 . 0,05 = 1,12 lít
b) Khối lượng axit clohiđric cần dùng
Theo phương trình hóa học, ta có:
nHCl = 2nFe = 2 . 0,05 = 0,1 mol
Khối lượng HCl cần dùng là: mHCl = M . n = 0,1 . 36,5 = 3,65 g
Bài 2 trang 75 sgk hóa học 8
Lưu huỳnh S cháy trong không khí sinh ra chất khí mùi hắc, gây ho, đó là khí lưu huỳnh đioxit có công thức hóa học là SO2
a) Viết phương trình hóa học của phản ứng lưu huỳnh cháy trong không khí.
b) Biết khối lượng lưu huỳnh đioxit tham gia phản ứng là 1,6 g. Hãy tìm:
- Thể tích khí lưu huỳnh đioxit sinh ra ở đktc
- Thể tích không khí cần dùng ở đktc. Biết khí oxi chiếm 1/5 thể tích của không khí.
Bài giải:
a) Phương trình hóa học của S cháy trong không khí:
S + O2 → SO2
b. Số mol của S tham gia phản ứng:
nS = \(\frac{16}{32}\) = 0,05 mol
Theo phương trình hóa học, ta có: \(n_{SO_{2}}\) = nS = \(n_{O_{2}}\) = 0,05 mol
=> Thể tích khí sunfurơ sinh ra ở đktc là:
\(V_{SO_{2}}\) = 22,4 . 0,05 = 1,12 lít
Tương tự thể tích khí oxi cần dùng ở đktc là:
\(V_{O_{2}}\) = 22,4 . 0,05 = 1,12 lít
Vì khí oxi chiếm 1/5 thể tích của không khí nên thể tích không khí cần là:
=> Vkk = 5\(V_{O_{2}}\) = 5 . 1,12 = 5,6 lít
Bài 3 trang 75 sgk hóa học 8
Có phương trình hóa học sau:
CaCO3 \(\overset{t^{0}}{\rightarrow}\) CaO + CO2
a) Cần dùng bao nhiêu mol CaCO3 để điều chế được 11,2 g CaO ?
b) Muốn điều chế được 7 g CaO cần dùng bao nhiêu gam CaCO3 ?
c) Nếu có 3,5 mol CaCO3 tham gia phản ứng sẽ sinh ra bao nhiêu lít CO2 (đktc) ?
d) Nếu thu được 13,44 lít khí CO2 ở đktc thì có bao nhiêu gam chất rắn tham gia và tạo thành sau phản ứng ?
Bài giải:
Phương trình phản ứng hóa học:
CaCO3 \(\overset{t^{0}}{\rightarrow}\) CaO + CO2
a) Số mol CaCO3 cần dùng là:
Theo phương trình phản ứng hóa học, ta có:
\(n_{CaCO_{3} }\) = nCaO = \(\frac{11,2}{56}\) = 0,2 mol
Vậy cần dùng 0,2 mol CaCO3 để điều chế CaO
b) Khối lượng CaCO3 cần dùng để điều chế 7g CaO là:
Số mol: \(n_{CaCO_{3} }\) = nCaO = \(\frac{7}{56}\) = 0,125 mol
Khối lượng CaCO3 cần thiết là:
\(m_{CaCO_{3}}\) = M . n = 100 . 0,125 = 12,5 gam
c) Thể tích CO2 sinh ra:
Theo phương trình phản ứng hóa học, ta có:
\(n_{CaCO_{3} }\) = nCaO = 3,5 mol
\(V_{CO_{2}}\) = 22,4 . n = 22,4 . 3,5 = 78,4 lít
d) Khối lượng CaCO3 tham gia và CaO tạo thành:
\(n_{CaCO_{3} }\) = nCaO = \(n_{CO_{2}}\) = \(\frac{13,44}{22,4}\) = 0,6 mol
Vậy khối lượng các chất: \(m_{CaCO_{3}}\) = 0,6 . 100 = 60 gam
mCaO = 0,6 . 56 = 33,6 gam
Bài 4 trang 75 sgk hóa học 8
a) Cacbon oxit CO tác dụng với khí oxi tạo ra cacbon đioxit. Hãy viết phương trình hóa học
b) Nếu muốn đốt cháy 20 ml CO thì phải dùng bao nhiêu mol CO2 để sau phản ứng người ta chỉ thu được một chất khí duy nhất ?
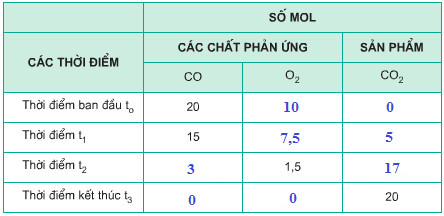
c) Hãy điền vào những ô trống số mol các chất phản ứng và sản phẩm có ở những thời điểm khác nhau. Biết hỗn hợp CO và O2 ban đầu được lấy đúng tỉ lệ về số mol các chất theo phương trình hóa học.
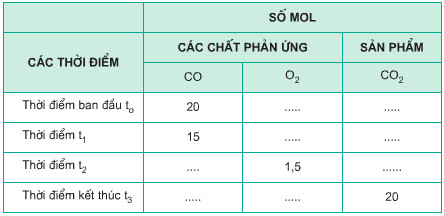
Trả lời:
a) Phương trình phản ứng:
2CO + O2 → 2CO2
b) Lượng chất CO2 cần dùng:
Theo phương trình phản ứng, để thu được một chất khí duy nhất là CO2 thì số mol các chất tham gia phản ứng phải theo đúng tỉ lệ của phương trình hóa học. Ta có:
\({n_{{O_2}}} = {1 \over 2}{n_{C{O_2}}} = 1.{{20} \over 2} = 10mol\)
c) Bảng số mol các chất:
Bài 5 trang 76 sgk hóa học 8
Hãy tìm thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A
Biết rằng:
- Khí A có tỉ lệ khối đối với không khí là 0,552
- Thành phần theo khối lượng của khí A là: 75% C và 25% H
Các thể tích khí đo ở đktc
Bài giải:
Khối lượng mol khí A tham gia phản ứng là:
dA/kk = 0,552 => MA = 29 . 0,552 = 16 g
mC = \(\frac{16 . 75}{100}\) = 12; mH = \(\frac{16 . 25}{100}\) = 4
Đặt công thức hóa học của khí A là CxHy, ta có:
12 . x = 12 => x = 1
1 . y = 4 => y = 4
Công thức hóa học của khí A là CH4
Phương trình phản ứng
CH4 + 2O2 → CO2 + 2H2O
Theo phương trình phản ứng, thể tích oxi bằng hai lần thể tích khí CH4 nên thể tích khí oxi đủ để đốt cháy hết 11,2 lít khí A là:
\(V_{O_{2}}\) = 2 . \(V_{CH_{4}}\) = 11,2 . 2 = 22,4 lít
Giaibaitap.me
Giải bài tập trang 79 bài 23 bài luyện tập 4 Sách giáo khoa (SGK) Hóa học 8. Câu 1: Hãy tìm công thức hóa học đơn giản nhất của một loại oxit của lưu huỳnh...
Giải bài tập trang 84 bài 24 tính chất của oxi Sách giáo khoa (SGK) Hóa học 8. Câu 1: Dùng từ hoặc cụm từ thích hợp trong khung để điền vào chỗ trống trong các câu sau...
Giải bài tập trang 87 bài 25 Sự oxi hóa - Phản ứng hóa hợp - Ứng dụng của oxi Sách giáo khoa (SGK) Hóa học 8. Câu 1: Dùng cụm từ thích hợp trong khung để điền vào chỗ trống trong các câu sau...
Giải bài tập trang 69 bài 26 oxit Sách giáo khoa (SGK) Hóa học 8. Câu 2: Lập công thức hóa học của một loại oxit của photpho, biết rằng hóa trị của photpho...
