Bài 33.9 Trang 48 Sách bài tập (SBT) Hóa học 8
Cho mạt sắt vào một dung dịch chứa 0,2 mol H2SO4 loãng. Sau một thời gian, bột sắt tan hoàn toàn và,người ta thu được 1,68 lít khí hiđro (đktc).
a) Viết phương trình hoá học.
b) Tính khối lượng mạt sắt đã phản ứng.
c) Để có lượng sắt tham gia phản ứng trên, phải cho bao nhiêu gam sắt(III) oxit tác dụng với khí hiđro ?
Trả lời
a) Phương trình hóa học:
\(Fe + {H_2}S{O_4} \to FeS{O_4} + {H_2} \uparrow \)
b) Khối lượng mạt sắt đã phản ứng:
\(Fe\,\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,{H_2}S{O_4} \to FeS{O_4} + {H_2} \uparrow \)
1 mol 1 mol 1mol
0,075 mol 0,075 mol 0,075 mol (\({n_{{H_2}}} = {{1,68} \over {22,4}} = 0,075\) )
Theo phương trình hóa học trên ta nhận thấy số mol axit cho dư (0,2 mol), nên tính khối lượng mặt sắt theo số mol hidro:
\({m_{Fe}} = 0,075 \times 56 = 4,2(g)\)
c) Phương trình hóa học :
\(F{e_2}{O_3}\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,3{H_2}\buildrel {{t^o}} \over\longrightarrow 2Fe\,\,\,\,\, + \,\,\,\,3{H_2}O\)
1 mol 3 mol 2 mol
x mol 0,075 mol
\(x = {{0,075} \over 2} = 0,0375(mol)\)
Khối lượng \(F{e_2}{O_3}\) cần dùng để điều chế lượng sắt trên là:
\({m_{F{e_2}{O_3}}} = 0,0375 \times 160 = 6(g)\)
Bài 33.10 Trang 48 Sách bài tập (SBT) Hóa học 8
Người ta cho kẽm hoặc sắt tác dụng với dung dịch axit clohiđric HCl để điều chế khí hiđro. Nếu muốn điều chế 2,24 lít khí hiđro (đktc) thì phải dùng số gam kẽm hoặc sắt lần lượt là
A. 6,5 g và 5,6 g. B. 16 g và 8 g.
C. 13 g và 11,2 g. D. 9,75 g và 8,4 g.
Trả lời
Phương án A.
\({n_{{H_2}}} = {{2,24} \over {22,4}} = 0,1(mol)\)
Phương trình hóa học :
\(Zn + 2HCl \to ZnC{l_2} + {H_2}\)
1 mol 1 mol
0,1 mol \(\leftarrow \) 0,1 mol
\({m_{Zn}} = 0,1 \times 65 = 6,5(g)\)
\(Fe + 2HCl \to FeC{l_2} + {H_2}\)
1 mol 1 mol
0,1 mol 0,1 mol
\({m_{Fe}} = 0,1 \times 56 = 5,6(g)\)
Bài 33.11 Trang 48 Sách bài tập (SBT) Hóa học 8
Điện phân hoàn toàn 2 lít nước ở trạng thái lỏng (biết khối lượng riêng D của nước là 1 kg/lít), thể tích khí hiđro và thể tích khí oxi thu được (ở đktc) lần lượt là
A. 1244,4 lít và 622,2 lít. B. 3733,2 lít và 1866,6 lít.
C. 4977,6 lít và 2488,8 lít. D. 2488,8 lít và 1244,4 lít.
Trả lời
Phương trình hóa học của phản ứng điện phân nước :
\(2{H_2}O\buildrel {dienphan} \over\longrightarrow 2{H_2}\,\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,\,\,\,{O_2}\)
2 mol 2 mol 1 mol
\(\left( {{{2 \times 1000} \over {18}}} \right)mol\) x mol y mol
\(x = {{2 \times 2 \times 1000} \over {18 \times 2}} = 111,11(mol)\)
\(y = {{2 \times 1000} \over {18 \times 2}} = 55,555(mol)\)
\({V_{{H_2}}}\) sinh ra là : 111,11 x 22,4 = 2488,8( lít)
\({V_{{O_2}}}\) sinh ra là : 55.555 x 22,4 = 1244,4 (lít).
Bài 33.12 Trang 48 Sách bài tập (SBT) Hóa học 8
So sánh thể tích khí hiđro (đktc) thu được trong mỗi trường hợp sau :
a) 0,1 mol Zn tác dụng với dung dịch H2SO4 loãng, dư.
1 mol AI tác dụng với dung dịch H2SO4 loãng, dư.
b) 0,2 mol Zn tác dụng với dung dịch HCl dư.
2 mol AI tác dụng với dung dịch HCl dư.
Trả lời
a) Phương trình hóa học:
\(Zn\,\,\, + \,\,\,\,\,\,{H_2}S{O_4} \to ZnS{O_4} + {H_2}\)
1 mol 1 mol
0,1 mol 0,1 mol
\(2Al\,\,\,\,\, + \,\,\,\,\,\,3{H_2}S{O_4} \to A{l_2}{(S{O_4})_3} + 3{H_2}\)
2 mol 3 mol
0,1 mol x mol
\(x = {{0,1 \times 3} \over 2} = 0,15(mol)\)
Thể tích khí hidro do 0,1 mol nhôm sinh ra nhiều hơn 0,1 mol kẽm sinh ra:
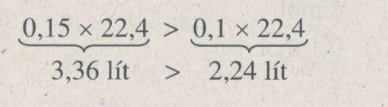
b) Phương trình hóa học:
\(Zn\,\,\,\,\,\,\,\, + \,\,\,\,\,\,\,2HCl \to ZnC{l_2}\,\,\,\,\, + \,\,\,\,\,\,\,\,{H_2}\)
1 mol 1 mol
0,2 mol 0,2 mol
\(2Al\,\,\,\,\,\,\,\, + 6HCl \to 2AlC{l_3}\,\,\, + \,3{H_2}\)
2 mol 3 mol
0,2 mol y mol
\(y = {{0,2 \times 3} \over 2} = 0,3(mol)\)
Thể tích khí hidro do 0,2 mol nhôm sinh ra nhiều hơn do 0,2 mol kẽm sinh ra:
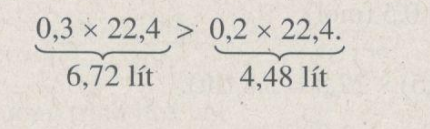
Giaibaitap.me
Giải bài tập Trang 48 bài 36 nước Sách bài tập (SBT) Hóa học 8. Câu 36.1: Cho các oxit: CaO ; Al2O3 ; N2O5, CuO ; Na2O ; BaO ; MgO ; P2O5 ; Fe3O4 ; K2O. ...
Giải bài tập trang 49 bài 36 nước Sách bài tập (SBT) Hóa học 8. Câu 36.5: Cho nổ một hỗn hợp gồm 1 mol hiđro và 14 lít khí oxi (đktc)...
Giải bài tập trang 49, 50 bài 36 nước Sách bài tập (SBT) Hóa học 8. Câu 36.9: Viết phương trình hoá học biểu diễn các biến hoá sau và cho biết mỗi phản ứng thuộc loại phản ứng nào....
Giải bài tập Trang 50 bài 37 axit - bazo và muối Sách bài tập (SBT) Hóa học 8. Câu 37.1: Dãy dung dịch nào dưới đây làm đổi màu quỳ tím thành xanh ?...
