Bài tập 8.17 trang 60 sách bài tập(SBT) hóa học 11
8.17. Hỗn hợp A chứa 2 ancol no, đơn chức, mạch hở. Để đốt cháy hoàn toàn hỗn hợp A cần dùng vừa hết 3,36 lít 02 (đktc). Trong sản phẩm cháy, khối lượng C02 nhiều hơn khối lượng H20 là 1,88 g.
1. Xác định khối lượng hỗn hợp A.
2. Xác định công thức phân tử và phần trăm khối lượng của từng chất trong A nếu biết thêm rằng hai ancol đó khác nhau 2 nguyên tử cacbon.
Hướng dẫn trả lời:
Cách 1.
1. Hỗn hợp A gồm X mol CnH2n+1OH và y mol CmH2m+1OH.
Khối lượng hỗn hợp A là :
(14n + 18)x + (14m + 18)y = 14 (nx + my) + 18(x + y)
\({C_n}{H_{2n + 1}}OH + \frac{{3n}}{2}{O_2} \to nC{O_2} + (n + 1){H_2}O\)
x mol \(\frac{{3n}}{2}\)x mol nx mol (n + 1)x mol
\({C_m}{H_{2m + 1}}OH + \frac{{3m}}{2}{O_2} \to mC{O_2} + (m + 1){H_2}O\)
y mol \(\frac{{3n}}{2}\)y mol my mol (m + 1)y mol
Số mol 02 : \(\frac{3}{2}(n{\rm{x}} + my) = \frac{{3,36}}{{22,4}} = 0,15(mol) \Rightarrow n{\rm{x}} + my = 0,1(1)\)
Hiộu khối lượng của C02 và của H20 :
44(nx + my) - 18[(n + 1)x + (m + 1)y] = 1,88
26(nx + my) - 18(x + y) = 1,88 (2)
Từ (1) và (2), tìm được : x + y = 0,04.
Khối lượng hỗn hợp A là : 14.0,1 + 18.0,04 = 2,12 (g).
2. Vì m = n + 2 ; ta có : nx + (n + 2)y = 0,1
\( \Rightarrow \) n(x + y) + 2y = 0,1 \( \to \) y = 0,05 - 0,02n
0 < y < 0,04 \( \Rightarrow \) 0,5 < n < 2,5
Nếu n=1, hai ancoỉ là CH3OH và \({C_3}{H_7}OH\)
\( \Rightarrow \) y = 0,03 và x = 0,01
\( \Rightarrow \) CH3OH chiếm 15,1% ; C3H7OH chiếm 84,9% khối lượng hỗn hợp A.
Nếu n=2, hai ancol là C2H5OH và \({C_4}{H_9}OH\)
\( \Rightarrow \) y = 0,01 và x = 0,03
\( \Rightarrow \) C2H5OH chiếm 65,1%, \({C_4}{H_9}OH\) chiếm 84,9% khối lượng hỗn hợp A.
Cách 2.
1. Công thức chung của hai ancol là \({C_{\overline n }}{H_{2\overline n + 1}}OH\) và tổng số mol của chúng là a. Khối lượng hỗn hợp : (14\(\overline n \) + 18)a.
\({C_{\overline n }}{H_{2\overline n + 1}}OH + \frac{{3\overline n }}{2}{O_2} \to \overline n C{O_2} + (\overline n + 1){H_2}O\)
a mol \(\frac{{3\overline n }}{2}\)a mol \({\overline n }\)a mol \((\overline n + 1)\)a mol
\( \Rightarrow \left\{ \begin{array}{l}
\frac{{3\overline n }}{2}a = 0,15\\
44\overline n a - 18(\overline n + 1)a = 1,88
\end{array} \right. \Rightarrow \left\{ \begin{array}{l}
\overline n = 2,5\\
a = 0,04
\end{array} \right.\)
Khối lượng hỗn hợp : (14.2,5 + 18).0,04 = 2,12 (g)
2. n < 2,5 < n + 2 \( \Rightarrow \) 0,5 < n < 2,50
Phần cuối giống như ở cách giải 1.
Bài tập 8.18 trang 60 sách bài tập(SBT) hóa học 11
8.18. Hỗn hợp A chứa glixerol và một ancol đơn chức. Cho 20,3 g A tác dụng với natri (lấy dư) thu được 5,04 lít H2 (đktc). Mặt khác 8,12 g A hoà tan vừa hết 1,96 g Cu(OH)2.
Xác định công thức phân tử, các công thức cấu tạo có thể có, tên và phần trăm về khối lượng của ancol đơn chức trong hỗn hợp A.
Hướng dẫn trả lời:
Khi 8,12 g A tác dụng với Cu(OH)2 chỉ có 1 phản ứng hoá học :
2C3H5(OH)3 + Cu(OH)2 \( \to \) [C3H5(0H)20]2 Cu + 2H20
đồng(II) glixerat
Số mol glixerol trong 8,12 g A = 2.số mol Cu(OH)2
= 2.\(\frac{{1,96}}{{98}}\) =0,04 (mol).
Số mol glixerol trong 20,3 g A là : \(\frac{{0,04.20,3}}{{8,12}} = 0,1(mol)\).
Khối lượng glixerol trong 20,3 g A là : 0,1.92 = 9,2 (g).
Khối lượng R-OH trong 20,3 g A là : 20,3 - 9,2 = 11,1 (g).
Khi 20,3 g A tác dụng với Na có 2 phản ứng hoá học
2C3H5(OH)3 + 6Na \( \to \) 2C3H5(ONa)3 + 3H2\( \uparrow \)
0,1 mol 0,15mol
2R-OH + 2Na \( \to \) 2R-ONa + H2\( \uparrow \)
x mol 0,5x mol
Số mol H2 = \(0,15 + 0,5{\rm{x}} = \frac{{5,04}}{{22,4}} = 0,225(mol) \Rightarrow x = 0,15\).
Khối lượng 1 mol R-OH : \(\frac{{11,1}}{{0,15}} = 74(g)\).
R-OH = 74 \( \Rightarrow \) R = 74 - 17 = 57 ; R là \( - {C_4}{H_9}\)
CTPT : \({C_4}{H_{10}}O\)
Các CTCT và tên :
\(C{H_3} - C{H_2} - C{H_2} - C{H_2} - OH\) ( butan-1-ol )
 ( butan-2-ol )
( butan-2-ol )
 ( 2-metylpropan-1-ol )
( 2-metylpropan-1-ol )
 ( 2-metylpropan-2-ol )
( 2-metylpropan-2-ol )
Bài tập 8.19 trang 60 sách bài tập(SBT) hóa học 11
8.19. Đun một hỗn hợp 2 ancol no, đơn chức, mạch hở với H2S04 ở 140°C, thu được 72 g hỗn hợp 3 ete với số mol bằng nhau. Khối lượng nước tách ra trong quá trình tạo thành các ete đó là 21,6 g.
Xác định công thức cấu tạo của 2 ancol và khối lượng mỗi ancol phản ứng.
Hướng dẫn trả lời:
\(\begin{array}{l}
{C_n}{H_{2n + 1}}OH + HO{C_n}{H_{2n + 1}} \to {C_n}{H_{2n + 1}} - O - {C_n}{H_{2n + 1}} + {H_2}O\\
{C_m}{H_{2m + 1}}OH + HO{C_m}{H_{2m + 1}} \to {C_m}{H_{2m + 1}} - O - {C_m}{H_{2m + 1}} + {H_2}O\\
{C_n}{H_{2n + 1}}OH + HO{C_m}{H_{2m + 1}} \to {C_n}{H_{2n + 1}} - O - {C_m}{H_{2m + 1}} + {H_2}O
\end{array}\)
Số mol 3 ete = số mol H20 = \(\frac{{21,6}}{{18}}\) = 1,2 (mol).
Số mol mỗi ete = \(\frac{{1,2}}{{3}}\) = 0,4 (mol).
Khối lượng 3 ete :
(28n + 18).0,4 + (28m + 18).0,4 + (14n + 14m + 18).0,4 = 72.0 \( \Rightarrow \) n + m = 3.
Vì n và m đều nguyên và dương nên chỉ có thể n = 1 và m = 2 (hoặc ngược lại).
Hai ancol là CH3-OH và CH3-CH2-OH.
Số mol mỗi ancol là 1,2 mol.
Khối lượng CH3-OH là : 1,2.32 = 38,4 (g).
Khối lượng C2H5OH là : 1,2.46 = 55,2 (g).
Bài tập 8.20 trang 60 sách bài tập(SBT) hóa học 11
8.20*. Hỗn hợp khí A chứa 2 anken kế tiếp nhau trong dãy đồng đẳng. Tỉ khối của A đối với khí nitơ là 1,35.
1. Xác định công thức phân tử 2 anken.
2. Nếu hiđrat hoá một lượng hỗn hợp A (giả sử hiệu suất là 100%) thì được hỗn hợp ancol B, trong đó tỉ lệ về khối lượng giữa ancol bậc một và ancol bậc hai là 43 : 50.
Hãy cho biết tên và phần trăm về khối lượng của từng ancol trong hỗn hợp B.
Hướng dẫn trả lời:
1. Hỗn hợp khí A chứa CnH2n và Cn+1H2n+2 với phân tử khối trung bình là : 1,35.28 = 37,8
\( \Rightarrow \) CnH2n < 37,8 < Cn+1H2n+2
\( \Rightarrow \) 14n < 37,8 < 14n + 14
1,70 < n < 2,70 \( \Rightarrow \) n = 2.
CTPT của 2 anken là C2H4 và C3H6.
2. Giả sử trong 1 moi hỗn hợp A có x mol C3H6 và (1 - x) mol C2H4 :
42x + 28(1 - x) = 37,8 \( \Rightarrow \) x = 0,7
Như vậy, trong 1 mol hỗn hợp A có 0,7 mol C3H6 và 0,3 mol C2H4.
Giả sử hiđrat hoá hoàn toàn 1 mol A :
CH2 = CH2 + H20 \( \to \) CH3 - CH2 - OH
0,3 mol 0,3 mol
CH3 - CH = CH2 + H20 \( \to \) CH3 - CH2 - CH2 - OH
a mol a mol
CH3 - CH = CH2 + H20 \( \to \) 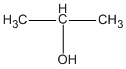
(0,7 - a) mol (0,7 - a) mol
Tỉ lệ khối lượng giữa ancol bậc I so với ancol bậc II :
\(\frac{{46.0,3 + 60{\rm{a}}}}{{60(0,7 - a)}} = \frac{{43}}{{50}} \Rightarrow a = 0,2\)
Hỗn hợp B gồm 0,3 mol CH3 - CH2 - OH ; 0,2 mol CH3 - CH2 - CH2 - OH và 0,5 mol 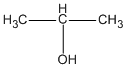 ; có khối lượng tổng cộng là 55,8 g.
; có khối lượng tổng cộng là 55,8 g.
% về khối lượng etanol (ancol etylic) là : \(\frac{{0,3.46}}{{55,8}}.100\% = 24,7\% \)
% về khối lượng của propan-l-ol (ancol propylic) là : \(\frac{{0,2.60}}{{55,8}}.100\% = 21,5\% \)
Propan-2-ol (ancol isopropylic) chiếm : \(\frac{{0,5.60}}{{55,8}}.100\% = 53,8\% \)
Riêng câu 2 cũng có thể lập luận như sau :
Phần trăm khối lượng của ancol bậc II (ancol isopropylic) :
\(\frac{{50}}{{43 + 50}}.100\% = 53,8\% \)
Vậy phần trăm khối lượng của 2 ancol bậc I là 46,2%.
Nếu dùng 1 mol A (37,8 g) thì lượng H20 là 1 mol (18 g) và khối lượng hỗn hợp B là 37,8 + 18, = 55,8 (g), trong đó 0,3 mol C2H4 tạo ra 0,3 mol ancol etylic.
Phần trăm khối lượng của ancol etylic là \(\frac{{0,3.46}}{{55,8}}.100\% = 24,7\% \) và của ancol propylic là 46,2% - 24,7% = 21,5%.
Giaibaitap.me
Giải bài tập trang 61 bài 41 phenol sách bài tập(SBT) hóa học 11. Câu 8.21: Chất nào không phải là phenol ?...
Giải bài tập trang 61, 62 bài 41 phenol Sách bài tập(SBT) hóa học 11. Câu 8.25: Sục khí cacbonic vào dung dịch natri phenolat ở nhiệt độ thường, thấy dung dịch vẩn đục...
Giải bài tập trang 62 bài 42 luyện tập dẫn xuất halogen, ancol, phenol Sách bài tập (SBT) hóa học 11. Câu 8.28: Cho lần lượt các chất C2H5Cl, C2H5OH, C6H5OH vào dung dịch NaOH đun nóng. Số chất phản ứng là ?...
Giải bài tập trang 63 bài 42 luyện tập dẫn xuất halogen, ancol, phenol Sách bài tập (SBT) hóa học 11. Câu 8.32: Chất A là một ancol no, đơn chức, mạch hở....
