Bài 1 trang 22 sgk Hóa học 11
Viết phương trình điện li của các chất sau : K2S, Na2HPO4, NaH2PO4, Pb(OH)2, HBrO, HF, HClO4.
Hướng dẫn giải:
Phương trình điện li :
a) K2S → 2K+ + S2_
b) Na2HPO4 → 2Na+ +. HPO42-
HPO42- \(\rightleftharpoons\) H+ + PO43-
c) NaH2PO4 → Na+ + H2PO4-
H2PO4- \(\rightleftharpoons\) H+ + HPO42-
HPO42- \(\rightleftharpoons\) H+ + PO43-
d) Pb(OH)2 \(\rightleftharpoons\) Pb2+ + 2OH- : phân li kiểu bazơ
H2PbO2 \(\rightleftharpoons\) 2H+ + PbO22- : phân li kiểu axit
e) HBrO \(\rightleftharpoons\) H+ + BrO-
g) HF \(\rightleftharpoons\) H+ + F-
h) HClO4 → H+ + ClO4-.
Bài 2 trang 22 sgk Hóa học 11
Một dung dịch có [H+] = 0,01 OM. Tính [OH-] và pH của dung dịch. Môi trường của dung dịch này là axit, trung tính hay kiềm ? Hãy cho biết màu của quỳ tím trong dung dịch này.
Hướng dẫn giải:
[H+]= 1,0.10-2M thì pH = 2 và [OH-] = 1,0 . 10-12 M.
Môi trường axit. Quỳ có màu đỏ.
Bài 3 trang 22 sgk Hóa học 11
Một dung dịch có pH = 9,0. Tính nồng độ mol của các ion H+ và OH- trong dung dịch. Hãy cho biết màu của phenolphtalein trong dung dịch này.
Hướng dẫn giải:
pH = 9,0 thì [H+] = 1,0. 10-9 M và [OH- ] = 1,0.10-5M.
Môi trường kiểm. Trong dung dịch kiềm thì phenolphtalein có màu hồng.
Bài 4 trang 22 sgk Hóa học 11
Viết các phương trình phân tử và ion rút gọn của các phản ứng (nếu có) xảy ra trong dung dịch giữa các cặp chất sau :
a) Na2CO3 + Ca(NO3)2
b) FeSO4 + NaOH (loãng)
c) NaHCO3 + HCI
d) NaHCO3+ NaOH
e) K2CO3+ NaCI
g) Pb(OH)2 (r) + HNO3
h) Pb(OH)2 (r) + NaOH
i) CuSO4 + Na2S
Hướng dẫn giải:
Phương trình ion rút gọn :
a) Ca2+ + CO32- → CaCO3 ↓
b) Fe2+ + 2OH- → Fe(OH)2↓
c) HCO3- + H+ → CO2 ↑ + H2O
d) HCO3- + OH- → H2O + CO32-
e) Không có phương trình ion rút gọn.
g) Pb(OH)2(r) + 2H+ → Pb2+ + 2H2O
h) H2PbO2(r) + 2OH- → PbO22- + 2H2O
i) Cu2+ + S2- → CuS↓.
Bài 5 trang 23 sgk Hóa học 11
Phản ứng trao đổi ion trong dung dịch các chất điện li chỉ xảy ra khi
A. Các chất phản ứng phải là những chất dễ tan.
B. Các chất phản ứng phải là những chất điện li mạnh.
C. Một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng
D. Phản ứng không phải là thuận nghịch.
Hướng dẫn giải:
Chọn C. Một số ion trong dung dịch kết hợp được với nhau làm giảm nồng độ ion của chúng.
Bài 6 trang 23 sgk Hóa học 11
Kết tủa CdS (hình 1,7a) được tạo thành trong dung dịch bằng cặp chất nào dưới đây ?

A. CdCI2 + NaOH
B. Cd(NO3)2 + H2S
C. Cd(NO3)2 + HCl
D. CdCl2 + Na2SO4
Hướng dẫn giải:
Chọn B. Cd(NO3)2 + H2S.
Bài 7 trang 23 sgk Hóa học 11
Viết phương trình hoá học (dưới dạng phân tử và ion rút gọn) của phản ứng trao đổi ion trong dung dịch tạo thành từng kết tủa sau : Cr(OH)3 ; AI(OH)3 ; Ni(OH)2 (hình 1.7 b, c, d).
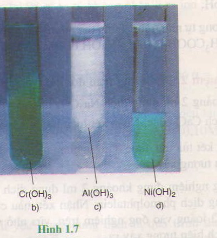
Hướng dẫn giải:
Cr(NO3)3 + 3NaOH(vừa đủ) → Cr(OH)3↓ + 3NaNO3 ;
AlCl3 + 3KOH (vừa đủ) → Al(OH)3↓ + 3KC1 ;
Ni(NO3)2 + 2NaOH → Ni(OH)2↓+ 2NaNO3.
Giaibaitap.me
Giải bài tập trang 31 bài 7 nitơ Sách giáo khoa (SGK) Hóa học 11. Câu 1: Ở điều kiện nào nitơ trở nên hoạt động hơn ...
Giải bài tập trang 38 bài 8 Amoniac và muối amoni Sách giáo khoa (SGK) Hóa học 11. Câu 1: Mô tả và giải thích hiện tượng xảy ra trong thí nghiệm chứng minh rằng ammoniac tan nhiều trong nước...
Giải bài tập trang 45 bài 9 Axit nitric và muối nitrat Sách giáo khoa (SGK) Hóa học 11. Câu 1: Viết công thức electron, công thức cấu tạo của axit nitric. Cho biết nguyên tố nitơ có hóa trị và số oxi hóa bao nhiêu...
Giải bài tập trang 49, 50 bài 10 photpho Sách giáo khoa (SGK) Hóa học 11. Câu 1: Trong điều kiện nào P trắng chuyển thành P đỏ và ngược lại ...
