Bài 1 trang 49 sgk hóa học 11
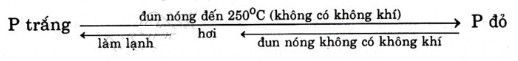
Nêu những điểm khác nhau về tính chất vật lí giữa P trắng và P đỏ. Trong điều kiện nào P trắng chuyển thành P đỏ và ngược lại ?
Bài giải:
P trắng:
Chất rắn màu trắng hoặc hơi vàng
Dễ nóng chảy, rất độc
Tan trong một số dung môi hữu cơ
Phát quang trong bóng tối
Bốc cháy trong không khí ở t° > 40°c
P đỏ:
Chất bột màu đỏ
Khó nóng chảy, không độc Không tan trong các dung môi thông thường
Không phát quang trong bóng tối
Bốc cháy trong không khí ở t° > 250°c
Bài 2 trang 49 sgk hóa học 11
Lập phương trình hóa học của các phản ứng sau đây và cho biết trong các phản ứng này, P có tính khử hay tính oxi hóa:
P + O2 → P2O5
P + Cl2 → PCl3
P + S → P2S3
P + S → P2S5
P + Mg → Mg3P2
P + KClO3 → P2O5 + KCl
Hướng dẫn giải bài 2:
4P + 5O2 → 2P2O5
2P + 3Cl2 → 3PCl3
2P + 3S → P2S3
2P + 5S → P2S5
2P + 3Mg → Mg3P2
6P + 5KClO3 →3 P2O5 +5 KCl
(5): p thể hiện tính oxi hóa
(1) (2) (3) (4) (6): p thể hiện tính khử 3
Bài 3 trang 49 sgk hóa học 11
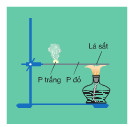
Thí nghiệm ở hình 2.13 chứng minh khả năng bốc cháy khác nhau của P trắng và P đỏ. Hãy quan sát, mô tả và giải thích hiện tượng xảy ra trong thí nghiệm. Viết phương trình hóa học của phản ứng xảy ra.
Bài giải:
Hiện tượng: P trắng bốc cháy, còn P đỏ không bốc cháy (hình 2.13, SGK).
Giải thích: P trắng hoạt động hóa học mạnh hơn P đỏ. P trắng tác dụng với oxi không khí dễ dàng hơn, tạo thành P2O5.
HS tự viết phương trình hóa học.
Bài 4 trang 50 sgk hóa học 11
Nêu những ứng dụng của photpho. Những ứng dụng đó xuất phát từ tính chất gì của photpho ?
Bài giải:
Những ứng dụng của photpho như SGK. Mỗi ứng dụng đó xuất phát từ tính khử hoặc tính oxi hóa của photpho.
Bài 5 trang 50 sgk hóa học 11
Đốt cháy hoàn toàn 6,2 g photpho trong oxi dư. Cho sản phẩm tạo thành tác dụng vừa đủ với dung dịch NaOH 32% tạo ra muối Na2HPO4.
a) Viết phương trình hóa học của các phản ứng xảy ra.
b) Tính khối lượng dung dịch NaOH đã dùng.
c) Tính nồng độ phần trăm của muối trong dung dịch thu được sau phản ứng.
Bài giải:
a) 4P + 5O2 \(\overset{t^{0}}{\rightarrow}\) 2P2O5 (1)
P2O5 + 4NaOH → 2Na2HPO4 + H2O (2)
b) Số mol P tham gia phản ứng: \(\frac{6,20}{31,0}\) = 0,200 (mol)
Từ (1) và (2) có sơ đồ hợp thức:
2P → P2O5 → 4NaOH → 2Na2HPO4 (3)
2 mol 1 mol 4 mol 2 mol
0,200 mol 0,100 mol 0,400 mol 0,200 mol
Từ đó tính được số gam dung dịch NaOH 32,0 % đã dùng là 50,0 gam.
c) Dựa vào (3) tính được 0,200 mol Na2HPO4.
MddNa2HPO4 = 14,2 gam + 50,0 gam = 64,2 (g)
C% dd Na2HPO4 = … x 100% = 44,2 %
Giaibaitap.me
Giải bài tập trang 54 bài 11 Axit photphoric và muối photphat Sách giáo khoa (SGK) Hóa học 11. Câu 1:
Giải bài tập trang 58 bài 12 phân bón hóa học Sách giáo khoa (SGK) Hóa học 11. Câu 1: Viết phương trình hóa học của các phản ứng đã dùng...
Giải bài tập trang 61, 62 bài 13 Luyện tập: Tính chất của Nitơ, photpho và các hợp chất của chúng Sách giáo khoa (SGK) Hóa học 11. Câu 1: Hãy cho biết số oxi hoá của N và p trong các phân tử và ion sau đây...
Giải bài tập trang 70 bài 15 cacbon - silic Sách giáo khoa (SGK) Hóa học 11. Câu 1: Tại sao hầu hết các hợp chất của cacbon lại là hợp chất cộng hóa trị ...
