Câu 5 trang 55 SGK Hóa học 11 Nâng cao
Tại sao khi điều chế axit nitric bốc khói phải sử dụng \({H_2}S{O_4}\)đặc và \(NaN{O_3}\) ở dạng rắn ?
Giải
Khi điều chế \(HN{O_3}\) bốc khói (\(HN{O_3}\) (tinh khiết) phải sử dụng \({H_2}S{O_4}\) đặc và \(NaN{O_3}\) ở dạng rắn vì: \(HN{O_3}\)tan nhiều trong nước và tạo thành hỗn hợp đẳng phí (68% \(HN{O_3}\))
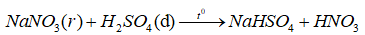
Loigiaihay.com
Câu 6 trang 55 SGK Hóa học 11 Nâng cao
Phản ứng giữa \(HN{O_3}\) với \(FeO\) tạo ra khí \(NO\). Tổng các hệ số trong phương trình của phản ứng oxi hóa – khử này bằng:
A. 22 B. 20
C. 16 D. 12
Giải
\(3FeO + 10HN{O_3} \to 3Fe{(N{O_3})_3} + NO \uparrow + 5H_2O\)
Chọn đáp án A
Câu 7 trang 55 SGK Hóa học 11 Nâng cao
Cho 13,5g nhôm tác dụng vừa đủ với 2,2 lít dung dịch \(HN{O_3}\) phản ứng tạo ra muối nhôm và một hỗn hợp khí gồm \(NO\) và \({N_2}O\). Tính nồng độ mol của dung dịch \(HN{O_3}\). Biết rằng tỉ khối của hỗn hợp khí đối với hiđro bằng 19,2.
Giải
Đặt số mol Al tham gia phản ứng (1) và (2) lần lượt là x mol và y mol.
\( \Rightarrow x + y = \frac{{13,5}}{{27}}\) (*)
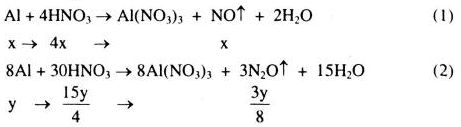
Hỗn hợp khí X gồm NO x mol: \({N_2}O\;\frac{{3y}}{8}\)mol
Theo đề bài ta có: 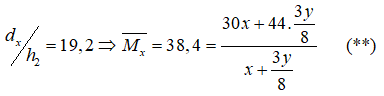
Giải hệ (*) và (**) ta được \(\left\{ \begin{array}{l}x = 0,1\\y = 0,4\end{array} \right.\)
Từ (1) và (2) \( \Rightarrow {n_{HN{O_3}}} = 4x + \frac{{15y}}{4} = 1,9\)mol
Nồng độ mol/lít của dung dịch \(HN{O_3}\) đã dùng:
\({CM_{{{HN{O_3}}}}} = \frac{{1,9}}{{2,2}} = 0,86M\)
Câu 8* trang 55 SGK Hóa học 11 Nâng cao
Đốt cháy hoàn toàn 4,4g một sunfua kim loại có công thức MS (Kim loại M có các số oxi hóa +2 và +3 trong các hợp chất) trong lượng dư oxi. Chất rắn thu được sau phản ứng hòa tan trong một lượng vừa đủ dung dịch \(HN{O_3}\) 37,8%. Nồng độ phần trăm của muối trong dung dịch thu được là 41,7%.
a) Xác định công thức của sunfua kim loại.
b) Tính khối lượng dung dịch \(HN{O_3}\)đã dùng.
Giải
a) Gọi khối lượng nguyên tử của M là M.
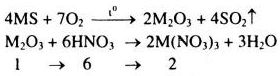
Xét 1 mol \({M_2}{O_3}\)
Khối lượng dung dịch \(HN{O_3}\) đã dùng: \({m_{{\rm{dd}}HN{O_3}}} = \frac{{6.63.100}}{{37,8}} = 1000(g)\)
Khối lượng dung dịch thu được sau phản ứng:
\({m_{{\rm{dd}}}} = {m_{{M_2}{O_3}}} + {m_{{\rm{dd}}HN{O_3}}} \)
\(= 1.(2M + 48) + 1000 = (2M + 1048)(g)\)
Khối lượng muối thu được sau phản ứng: \({m_{ct}} = {m_{M{{(N{O_3})}_3}}} = 2.(M + 186)(g)\)
Theo đề bài ta có: \({C_\% } = \frac{{{m_{ct}}.100}}{{m{\rm{dd}}}} \Rightarrow 41,7 = \frac{{2(M + 186).100}}{{2M + 1048}}\)
\( \Rightarrow M = 56g/mol(Fe)\)
b)

\(F{e_2}{O_3} + 6HN{O_3} \to 2Fe{(N{O_3})_3} + 3{H_2}O\) (2)
\(0,025 \to 0,15\)
Từ (1) và (2) \( \Rightarrow {n_{HN{O_3}}}\) = 0,15 mol
Khối lượng dung dịch \({HN{O_3}}\) 37,8% đã dùng là:
\({m_{{\rm{dd}}}} = \frac{{0,15.63.100}}{{37,8}} = 25(g)\)
Giaibaitap.me
Giải bài tập trang 57 bài 13 luyện tập tính chất của nito và hợp chất của nito SGK Hóa học 11 Nâng cao. Câu 1: Viết các phương trình hóa học để thực hiện các sơ đồ chuyển hóa sau...
Giải bài tập trang 62 bài 14 photpho SGK Hóa học 11 Nâng cao. Câu 1: Tại sao photpho đỏ và photpho trắng lại khác nhau về tính chất vật lí ? Trong điều kiện nào thì photpho trắng chuyển thành photpho đỏ và ngược lại?...
Giải bài tập trang 62 bài 14 photpho SGK Hóa học 11 Nâng cao. Câu 4: Magie phothua có công thức là...
Giải bài tập trang 66 bài 15 axit photphoric và muối photphat SGK Hóa học 11 Nâng cao. Câu 1: Viết công thức cấu tạo của axit photphoric, axit metaphotphoric và cho biết các axit này có số oxi hóa của photpho là bao nhiêu...
